Prof. Dr. Dr. Aykut Mısırligil
Klinikte hijyen – önce dişhekiminin kendi güvenliği
Hastadan dişhekimine ve tersi yönde bulaşabilecek hastalıklar; başta Hepatit B, C ve AIDS olmak üzere şöyle özetlenebilir: Herpes virus, influenza virus ve coxaci virus infeksiyonları, sfiliz, tüberküloz, lejyonelloz, streptokok infeksiyonları ve nonspesifik bakteri infeksiyonları. HBV’nin MS2 suşlarının da ağız yoluyla bulaştığı düşünülmektedir.
Diş tedavisi için müracaat eden bireyler; 1) sağlıklı, 2) taşıyıcı, 3) aktif hasta olabilirler. Fakat her zaman bu bireyleri aktif hasta olarak ve vücut salgılarını da infektif olarak kabul etmek gerekir. Sağlık personeli, hemodiyaliz ve transfüzyon hastaları, homoseksüeller, ilaç bağımlılarının vücut çıkartıları infektivitesi daha yüksektir. Hekim grubu içerisinde kan ve kan ürünleri ile uğraşan cerrahlar, dişhekimleri, jinekologlar ve bunların yardımcı personeli daha fazla infeksiyon riski altındadır. Bütün bu hastalıklar hava ve alet aracılıklı (indirekt) veya doğrudan temas ile (direkt) dişhekiminin elindeki bir kesikten bulaşabilir. Doğrudan bulaşmalarda dişhekiminin hasta olup olmayacağı, kontamine materyalden aldığı mikroorganizma sayısı ve konak direncine bağlıdır.
Dişhekiminin eline enjektör veya kanal aleti batması durumunda derhal eldiven çıkartılmalı, bol antiseptik kullanarak yaranın dezenfeksiyonu yapılmalı, daha sonra yeni bir eldiven giyilmelidir. Yaraya yapılacak pansumanın herhangi bir yara pansumanından farkı yoktur. Ancak infeksiyöz materyal Hepatit B şüpheli ise, bu durumda bağışık gamma globülin injeksiyonları gerekebilir. İndirekt bulaşmalarda mikroorganizma taşıyıcılığına en sık aracılık eden ise havadır.
Klinik çalışma odalarında aerosol kontrolü
Çapraz infeksiyonun (Cross-infection) önleme bakımından muayenehanelerde kullanılan aletlerin sterilizasyonu ve yüzeylerinin dezenfeksiyonu ne kadar önemli ise, diş aerosolleri yolu ile hastalıkların nakli de o kadar önemlidir. Çalışma ortamındaki aerosoller, dişhekimi ve hastaları için ciddi bir sağlık tehlikesi oluşturmaktadır.
Aerosol’ler: Direkt ve indirekt olarak dişhekimlerini etkilemektedir. Dişhekimlerinin vazgeçilmez aygıtları olan ve dakikada 200-300 bin devirle çalışan aerotorlarla ağız içinde yapılan çalışmalarda, su ve hava karışımı, frezin ucuna fokuslanarak pulvarize edilmektedir. Diş yüzeyine çarpan hava ve su karışımının bir kısmı, tekrar odanın havasına karışarak aerosol oluşturur. Bu sırada ağız florasından on binlerce bakteri ve virus, bu su damlacıkları üzerine yüklenir. Bu damlacıklara droplet adı verilir. Dropletler son derece infeksiyöz partiküllerdir. Dental aerosoller, 1 cm3 ‘te yaklaşık 100 bin bakteri içerir. Bu miktar öksürük ile havaya saçılan bakteri sayısından iki kat daha fazladır. Dropletlerin sayısı, hastanın salyasının yüzey gerilimine, püskürtülen havanın basıncına ve püskürtme açısına bağlı olarak değişir. Aerotor ve su spreyi hasta ağızında iken, 2 m. uzakta infeksiyöz dropletler bulunur. 4 m. uzaklıkta sayıları daha azdır. Her hastadan sonra muayene odasında bulunan mikroorganizma sayısında 30 kat artış olduğu bilinmektedir. Bunun sebebi, aerotor ve hava su spreyinden havaya karışan aerosollerdir. Dropletlerin çapları infeksiyon riski üzerinde belirleyicidir.
1. Çapları 10 µm den büyük olan dropletlerin çoğu solunum yoluna giremezler. Bu partiküller üst solunum yolunun tek katlı epitelinin silyaları tarafından tutulurlar. Bu büyüklükte partiküller konuşma, öksürme ve hapşırma sırasında havaya bol miktarda saçılırlar ve partikülün hızı fazla olduğu için uzağa gidebilirler. Hızla odanın zeminine doğru çökerler. İnfeksiyon yapabilme ihtimalleri diğerlerine göre daha azdır ama imkansız değildir.
2. Çapları 3-5 µm olan dropletler infeksiyözdür. 1000-10 000 tanesi ile farede deneysel olarak infeksiyon başlatılabilmektedir. Muayene odasındaki sayıları ancak 30 dakika sonra yarıya iner.
3. Çapları 1-2 µm olan partiküller de infeksiyon riski fazla olan grubu oluşturur. Bunların yarısı veya tamamına yakın miktarı inspirasyon ile akciğer alveollerine kadar gidebilir. Bir kısmı havada asılı olarak kalabilir ve hasta muayenesinden sonra da odanın atmosferinde bulunurlar. Dişhekimliğinde en büyük infeksiyon riskini bu çaptaki partiküller oluşturmaktadır.
4. Çapları 1-2 µm den küçük olan partiküller alveollere kolayca ulaşabilirler, fakat, ekpirasyon havası ile tekrar dışarı atılırlar. Bu nedenle diğerleri kadar infeksiyöz sayılmazlar. Bir kok hücresinin çapı 1 µm olarak düşünüldüğünde, bu dropletin bakteri yükleyemeyeceği anlaşılır. Bunlar sadece virus ve prionları taşıyabilirler. Bu büyüklükteki dropletler muayene odasının havası içerisinde saatlerce asılı olarak kalabilirler. Ancak günler sonra zemine çökerler veya sadece ventilasyon ile uzaklaştırılabilirler.
İndirekt aerosol yayılımında ise, büyük partiküllü damlacıkların, ekspoze cisimler, elbiseler ve yere düşmesi, daha sonrada kuruyarak toza karışması rol oynar. Bu kurumuş sekresyonların bir kısmı enfeksiyöz olup, güneş ışığı almayan yerlerde haftalarca hatta aylarca yaşayabilir. Mycobacterium tuberculosis ve Strep. pyogenes gibi bakteriler bu olayın güzel bir örneğini teşkil edip, kuru bezle toz alma, yerlerin süpürülmesi ve yatakların düzeltilmesi gibi durumlarda tekrar havada uçuşabilir. Bir mendilin çırpılması ile de infeksiyöz potansiyele sahip bakteriler havaya karışabilir. Kontamine gıda alımı ile meydana gelen streptokokkal boğaz ağrısı veya enfekte süt içilmesi ile görülen bazı difteri vakaları literatürde mevcuttur.
Dişhekimliği hastahane ve kliniklerinde aerotor, su ve hava spreyi, kavitron gibi aygıtların kullanılması sırasında bu aerosol kaynaklı ufak ve büyük partiküller, dişhekimleri, hastaları ve hatta bekleme odasındaki ziyaretçiler için son derece büyük tehlikeler oluşturmaktadır. Kızıl, kızamıkçık, Hepatit B (HBV), Hepatit C (HCV), Herpes, AIDS gibi viral infeksiyonlu hastalar tanımlandığında, kesinlikle ultrasonik temizleyiciler ve aerotorlarla çalışılmamalıdır. A.B.D.’de 1,5 milyona yakın kronik HBV taşıyıcısı olup, her yıl bu sayıya 200.000 kişi eklenmektedir. HBV infeksiyonlarında henüz kesin bir çözüm bulunmayıp tedavisi yoktur ve bu hastalık kronik hepatit, siroz ve karaciğer kanserine yol açmaktadır.
Dişhekimini, yardımcısını ve hastaları aerosollerin potansiyel riskinden korumak için aşağıdaki önlemler alınmalıdır:
1. Dental aerosollerdeki mikroorganizma sayısını azaltmak.
2. Meydana gelen toplam aerosol miktarını minimale indirmek.
3. Bireyleri dental aerosollere karşı korumak.
Dental aerosollerdeki mikroorganizma sayısını azaltmak
Ünitlerin su tanklarının her gün temizlenmesi ve tankların içine zaman zaman dezenfektan solüsyonların konulması gibi önlemler dental aerosollerdeki mikroorganizma sayılarını azaltacaktır. Buna ilaveten, hastaların tedavi önceleri hemen dişlerini fırçalamaları veya belirli dezenfektanlarla gargara yapmaları, oral floralarındaki bakteri sayısında büyük bir azalmaya yol açmaktadır. Bu konuda Ank.Üniv. Diş Hek. Fakültesi’nde yapılan bir çalışmada, %10’luk kalay florür (SnF2) ile yapılan 5 dakikalık ağız gargarasının bakteri sayısında %74 oranında bir azalmaya yol açtığı ispatlanmıştır. Yine, benzer bir çalışmada, distile su ile ağız gargarasının sonucu, aerotorlarla yapılan 60 saniyelik çalışmalarda aerosollerdeki organizma sayısında %35 oranında azalma olduğu bulunmuştur. Hastanın ağzı ayrıca klorheksidinli bir gargara ile de çalkalanabilir. Dental aerosollerin mikrop seviyelerinin azalmasında rubber dam’lar da büyük bir fayda sağlamaktadır.
Aerosol meydana gelimini azaltmak
Bu işlem için aşağıdaki yöntemler kullanılabilir:
a. Kuvvetli bir emici (suction) ile tükürüğün emilmesi ve bu yolla aerosol oluşumuna mani olunması.
b. Kavite preperasyonlarının hava ve su spreyi ile temizlenmesi yerine sadece su kullanılması aerosol oluşumunu azaltacaktır.
c. Çürüklü lezyonlarda çalışırken aerotor başlığı kullanmadan önce, el aletleri ile yumuşak materyelinin temizlenmesi ve ondan sonra aerotorla temizlenmeğe başlanılması.
d. Amalgam ve diğer restorasyonların cilalanmasında fırça yerine lastik cilalayıcıların kullanılması daha az aerosol oluşturacaktır.
Bireylerin aerosollere karşı korunması
a.Yüz maskeleri: Aerosol oluşturabileceği düşünülen bir tedavi uygulamasında hekimler mutlaka yüz maskeleri kullanmalıdırlar. Maskeler hem hastayı, hem de hekimi koruyarak iki yönlü fonksiyon görürler. Maskeler kliniğin sadece tedavi ünitelerinde takılmalıdırlar. Düşük enfeksiyon riskli hastalarda aynı maske, 4-5 hasta için kullanılabilir. Bu grup hastalar için “kaplumbağa kabuğu” tipli maskeler yeterli olurken, hastalığı bilinen veya enfekte olmasından şüphe edilen hastalar için 1 mikron büyüklüğündeki partikülleri bile %96 oranında geçirmeyen cerrahi tipi geniş yüz maskeleri kullanılmalıdır. Yüksek enfeksiyon riskli hastalarda kullanılan maskeler çöpe atılmadan önce mutlaka steril edilmeli, ondan sonra atılmalıdır.
b.Gözlerin korunması: Bütün dişhekimliği personeli, gerek kliniklerde, gerekse laboratuvarlarda kırılmaya karşı dirençli göz koruyucuları ve yanları kapalı gözlükler kullanmalıdırlar. Bunlar tek başlarına kullanılacağı gibi dereceli gözlükler üzerinde de kullanılabilirler. Diş tedavilerinde gözler herzaman için zedelenmeye maruz kalabilirler. Aerotörle bir amalgam dolgunun kaldırılması sırasında kopan madde, 750 km/saat’e ulaşabilen bir hızla ağızı terk edip gözünüze çarpabilir. Koruyucu gözler, devamlı oluşan aerosol, diş taşları gibi çeşitli riskli faktörlere de devamlı açıktır. Supin pozisyonundaki hastada kimyasal maddelere ve endodontik tedavide kullanılan ucu sivri aletlerin çarpmasına rahatlıkla maruz kalabilir. Lens kullanan hastalar tedavi sırasında lenslerini çıkartmalıdırlar. Otoklav kullanımının plastiklerin optik özelliklerini bozduğu bilindiğinden, gözlüklerin temizliğinde (dezenfeksiyonunda) glutareldehid kullanılabilir.
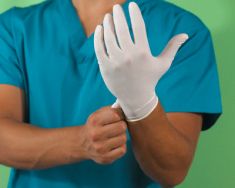
c.Eldivenler: Bütün diş tedavilerinde çapraz infeksiyonu önlemede eldivenler en önemli görevi üstlenmektedirler. Çünkü korunmasız eller, çok ciddi bir çapraz infeksiyon tehlikesi yaratırlar. Eldivenler, hekimin ellerindeki deri çatlağı, yara ve zedelenmelere ağız içindeki çeşitli bakterilerin nüfuz etmesini önler. Eldivenler içindeki sıcak, nemli atmosferde bakteriler süratle üreyebileceğinden ilk giyildiğinde eller tamamen temiz olmalıdır. Eldiven giyilmeden önce ellere uygun dezenfektanın sürülmesi, eldivenin ani yırtılma durumunda koruyucu bir bariyer teşkil edecek ve bu durumlarda içeri girip çıplak el yüzeyine temas edecek mikroorganizmalar infeksiyon yeteneklerini yitirecektir. Eldivenlerin bir koruma sağlayabilmeleri için, üzerlerinde bir delik veya yırtık bulunmamalıdır. Yeni eldivenlerin bile üzerinde %5 ile %14 arasında değişen oranda mikro delikler olabilir. Hatta, tabii kauçuktan imal edildikleri için eldivenlerin %80 kadarı kullanım sırasında ve %50’sine yakını kullanımdan önce bakteri ve muhtemelen viruslara geçirgen olabilir. Fakat, latex eldivenler HIV’ye karşı önleyici etki gösterebilirler. Üst üste iki eldiven giyilmesi deliklerden derinin kontaminasyonunu önleyebilir, fakat bu hassas dişhekimliği işlemleri esnasında veya riskin az olduğu durumlarda pratik değildir.
Çok az da olsa bazı hekimler ve teknisyenler kullandıkları latex eldivenlere karşı dermatolojik reaksiyonlar ve hipersensitivite reaksiyonları gösterdiklerini belirtmektedirler. Eldivenlerin ellerde meydana getirdikleri dermatitlere bağlı cilt problemleri; irritan kontakt dermatiti, allerjik kontakt dermatiti ve kontakt üritikeri, olarak üç grupta toplanabilir. Bu grup hekimlere ise, fiyatı son yıllarda hemen hemen aynı orana inen plastik polyvinyl eldivenler önerilmektedir. Ayrıca cilt üzerine sprey olarak sıkılan bir mikrofilm (örn; invisible skin) veya cilt kremleri de (örn; Skin Friend Cream) bu konuda hekimlere yardımcı olabilir. Yalnız, latex eldivenlerin tabii kauçuktan imal edildikleri için, çok az çevre kirliliğine yol açtıkları diğer polyvinyl’lerin ise doğada uzun yıllar çözülmedikleri unutumamalıdır. Eldivenlerin tekrar kullanılması ise, tartışmalı bir konudur. Her hasta için ayrı bir eldiven kullanılabileceği gibi, eldivenli eller de yıkanabilir (en fazla 5 kez). Bir başka eldivenin kullanılması istendiğinde, eller çıplak halde yıkanmalı ve kurulanmalıdır. Cerrahi operasyonlarda ve yüksek riskli hastalarda ise özellikle hep yeni ve steril eldivenler kullanılmalıdır.
d.Önlük ve üniforma: Hasta tedavisi ile meşgul olan bütün personel kesinlikle önlük kullanmalıdır. Önlükler gün aşırı temizlenmeli ve klinik dışında asla kullanılmamalıdır.
e.Sterilizatörler: Ultrasonik temizleyiciler dahil her türlü sterilizatörün kapakları devamlı olarak kapalı tutulmalı ve aerosollerin kliniğe yayılması önlenmelidir.
f.Sigara ve yemek: Tedavi bittikten saatlerce sonra bile aerosol partikülleri havada askıda kalacağından, özellikle ünitin bulunduğu odada yiyecek kesinlikle yenilmemelidir. Ayrıca bu bölgelerde sigarada içilmemelidir.
g.Ayakkabı giyimi: Kesin aletlerin düşüp yaralanmalara yol açma ihtimalleri olduğundan, dişhekimliği muayenehanelerinde delikli ve üstü açık ayakkabılar hiçbir zaman giyilmemelidir. Mümkünse bu ayakkabılar uzun çalışma saatlerine uygun, rahat, topuksuz, kimyasal dezenfeksiyona ve makinada yıkanmaya dayanıklı olmalıdır. Dışarıdan taşınabilecek zararlı mikroorganizmaları önlemek için hastalara galoş verilmeli, hekim ve yardımcıları ise muayenehanelerde kullandıkları ayakkabıları dışarıda kullanmamalıdırlar.
Tedavi odasının dekontaminasyonu
İnfeksiyon kontrolündeki ana hedef, çapraz kontaminasyonunun elimine edilmesidir. Diş kliniklerinde bulunan malzeme ve aletler pek çok değişik materyelden imal edilmiştir. İnfeksiyon kontrolünde ise bunların her biri ayrı ayrı problem yaratır. Bazı aletler kolaylıkla temizlenirlerken, bazıları kimyasal ajan ve dezenfektanlardan gayet kötü bir şekilde etkilenirler. Yuvarlak kenarlı ve etrafı düz, sert maddelerle kaplı aletler kolay temizlenirken, üstü kumaş kaplı kordon, sivri köşeli çeşitli kumanda düğmeleri, derin yivli aletler ve oyuklu yüzeyler, gayet zor temizlenirler. Klinikte yeni malzeme alımında cihazın dış hatlarının şekli ve yapıldığı madde de mutlaka göz önünde bulundurulmalıdır.
Muayene odasının temizliği
Demirbaş eşyalar: Dropletler reflektöre, menziline giriyorsa, tablet, sehpa ve küvet gibi demirbaş eşyaların üzerine sıçrar ve yüzeye yapışır. Böyle eşyaların yüzeyinde yarım gün kadar sonra kurur. Kan kaynaklı bazı mikroorganizmalar (örn; HBV) ve tüberküloz basili, kuruluğa karşı oldukça dayanıklıdır ve günlerce (hatta haftalarca) bulunduğu yüzeyde kalabilir. Bu süre içerisinde infektif olma özelliğini kaybetmez.
Böyle droplet sıçramaya müsait mesafede (yaklaşık 1,5-2 m) bulunan yatay düzlem veya demirbaş eşyalar, spreyleme yöntemi ile dezenfekte edilir. Sprey daima uzaktan ve yukarıya doğru sıkılmalıdır. Spreyden pulverize olan, antiseptiğin dropletlere en geniş bölgede temas etmesi sağlanmalıdır. Yüzeyler, önce spreylenir sonra temiz bir peçete kağıdı ile silinir. Bu peçete kağıdı atılır. Daha sonra yüzey yeniden spreylenir. Böyle bırakılır, silinmez. Buna SWS (spray-wipe-spray) denir. Daha güvenli olan bir kez daha silip ondan sonra spreyliyerek bırakmaktır (SWSWS). Böyle spreyler ticari olarak piyasada bulunur, bir çoğu lizol veya dörtlü amonyum bileşikleri içerir, metalik cisimler üzerine korozyon yapacağı çekincesi olmadan güvenle kullanılabilir. Bu dezenfeksiyon her hastadan sonra yapılmalıdır. Veya droplet sıçrayan yüzeyler temiz bir peçete kağıdı ile kapatılır her hastadan sonra bu peçeteler atılarak bir yenisi konulmalıdır.
Döşeme: Muayene odasında döşemeler için en uygun dezenfektan sodyum hipoklorit (NaOCI)’tir. Yani marketlerde satılan çamaşırsuyu (hipo) olarak bilinen %54’lük NaOCI’dir. Korozyon tehlikesi olmayan her yüzey için en mükemmel dezenfektan daima budur. Eğer NaOCI dişhekimliğinin metalik aletlerinde de kullanılabilseydi, başka hiç bir alternatif dezenfektan kullanılmasına gerek olmayacaktı. Muayene odasının yer döşemesi daima kolay silinebilir olmalıdır. Halı, kilim, örtü veya benzeri dekoratif eklentilerden kaçınmalıdır. En cilalı yüzeye sahip yer döşemesi en ideal olanıdır. Muşamba, deri veya vinileks yerine kaygan seramik döşemeler mikrobiyolojik açıdan daha makbuldur.
Hava: Muayene odasının havasının infeksiyöz droplet partikülleri ile istila edildiği durumlarda spreyleme yeterince güven telkin edici değildir. Uluslararası standartlar muayene odasının ameliyathanelerde uygulanan laminar havalandırmasını öngörmektedir. Tavandan aşağıya doğru ısıtılmış, nemlendirilmiş ve filitrelerden geçirilmiş mikropsuz hava, hastanın tam üzerinden dikey istikamette döşemeye doğru üfürülür. Böylece havada asılı kalan bütün dropletler derhal döşemeye yapışır ve oradan kalkamaz. Ancak böyle havalandırmalarda bazı mahzurlar vardır: 1)ayak hizasındaki hava basıncı ile kafa hizasındaki hava basıncı rahatsız edici bir fark oluşturur, 2)yere çarpan hava tekrar yükselerek konveksiyon akımları oluşturmaya meyillidir. Bunun önüne geçebilmek için odanın havası, ayak hizasından eksozlanarak dışarı atılır. Böylece hem sabit debisi olan bir temiz hava sirkülasyonu oluşur hem de dropletler daima yerde kalır. Laminar havalandırma sistemleri belirli aralıklarla hava filitrelerinin değiştirilmesini gerektirir. EPA (Environmental Protection Agency) standartlarına uygun mikroptan arındıran laminar havalandırma ve filitreleme sistemleri piyasada satılmaktadır.
Odanın döşeme, duvar ve havasının zaman gerektiren bir başka dezenfeksiyon metodu noniyonize radyasyon ile mümkündür. Bu amaçla ultraviyole (UV) lambalar kullanılır. UV lambalar elektrik ve tıbbi malzeme satıcılarından temin edilebilir. Akkor filamanlı olabileceği gibi floresan şeklinde de olabilir. Bu ışık, 380-460 nm dalga boyunda mor renklidir, göze zararlıdır. Yanmakta olan UV lambaya çıplak göz ile bakıldığında retina dekolmanlarına ve eritrosit lizisine sebep olabilir. Asıl etkisi RNA’dan urasil kopartmasıdır. Bu ışığa maruz kalan mikroorganizmaların ribozomal RNA larındaki urasil bulunduğu nükleik asit zincirini terk eder. Mantarlar, sporlar üzerine etkisizdir, bazı bakteriler üzerine ve DNA virüslerine tamamen etkisizdir. Ancak uzun süre (saatlerce) UV ışığa maruz kalan mikroorganizmalar kuvvetle inhibe olmaktadır. UV lambalar muayene odasının tavanına veya duvarına monte edilir. Yakıldığında odanın eşyaları sebebiyle gölgede kalan ve UV ışığı almayan yerlerde mikroorganizma inhibisyonu devam etsin diye daima karşılıklı olarak en az 2 tane lamba kullanılmalıdır. Hiç kimsenin bulunmadığı saatlerde yakılır. Uzun süre yanık kalmasının bir mahzuru yoktur. Işığın şiddeti, uzaklığın karesi ile ters orantılıdır. 40 m2’lik 3 metre yüksekliğindeki bir odanın tavanına 2 tane 40 watlık UV lamba konulmuş olsaydı döşemede UV ışık enerjisi 8,9 Watt olurdu. Göz hizasında ise 47 Watt olurdu. UV ampulleri yakılınca oda derhal terk edilmelidir. Muayene odası günler veya haftalarca kullanılmayacaksa, buharlaşabilen bir antiseptik şişesinin kapağı açık bırakılabilir. Bu amaçla fenol içeren bir antiseptik (krezoform, asit fenik vs) kullanılabilir. Fenol buharları odanın havasına karışarak, zemin, duvarlar, tavan ve havayı dezenfekte eder. Bir atmosfer hava basıncında, oda ısısında, 8 saatte yaklaşık 0,5 ppm fenol vaporize olarak odanın havasına karışır. Vaporizasyon hızı ilk saatte yüksektir, daha sonra yavaşlar. Soluk alınan havadaki insan sağlığını tehdit eden fenol miktarı 3 ppm dir. Muayene odası tekrar kullanılmadan önce iyice havalandırılmalıdır.
Hava yolu ile bulaşabilecek sayısız hastalık vardır. Bunların içerisinde en önemlilerinden birisi tüberkülozdur. Mycobacterium tüberculosis, 3-5 mm’den büyük partiküller içerisinde günlerce yaşamaya devam edebilir, kuru ortamda 9 saat canlı kalabilir ve infektivitesini devam ettirir. Dünya Sağlık Örgütü’nün (WHO) 1995 raporunda tüberkülozun giderek artan frekansı, Ebola virus infeksiyonları ve birçok kanserden daha fazla bulunmuştur. En dirençli mutantlar ise Kazakistan ve NewYork bölgesinden rapor edilmiştir.
Ellerin yıkanması
Genellikle hastahanelerden ve diş kliniklerinden kaynaklanan infeksiyonlara ”hastahane infeksiyonları” veya “nozokomiyal infeksiyonlar” adı verilmektedir. Bu tür infeksiyonlardan korunmada ise el yıkama, en başta gelen önlem olarak gösterilmektedir. Ellerin yıkanmasındaki amaç, hastalara ve kontamine yüzeylere temasla ellere bulaşan geçici organizmaların temizlenmesidir.
Cilt florası: Cilt üzerinde iki tür flora bulunmaktadır. Daimi ve geçici flora. Daimi organizmalar cilt üzerinde yaşamalarını sürdürüp çoğalabilirler. Bunların kültürleri yapılabilir. Düşük virülanslıdırlar ve cilt üzerinden kolaylıkla elimine edilemezler. Geçici florayı oluşturan bakteriler cilt üzerinde uzun süre yaşayıp çoğalamazlar. Akan bir su altında ellerin ovuşturularak yıkanması, bu tür geçici bakterilerin cilt üzerinden elimine edilmesinde yeterli bir mekanik etkidir.
Antiseptik sabunlar: %4’lük klorheksidin glukonat, %0,75 povidon iyot ve %3’lük heksaklorofen üzerinde yapılan araştırmalar, dezenfektanlar arasında en üst etkiye sahip olarak klorheksidin glukonatın olduğunu, bunun povidon iyot’un geniş spektrumu ile heksaklorofenin uzun etki süresini birleştirdiğini ortaya koymuştur. Klorheksidin, eller üzerindeki daimi ve geçici floraya uzun süreli etki yapar. Çok az vakada sekonder dermal infeksiyonlara yol açar. Çalışma gününün ilk el yıkamasında klorheksidin kullanılıp, buna göre daha az antimikrobiyal etkiye sahip ucuz koruma ajanları müteakip el yıkamalarda tercih edilmelidir. Özetleyecek olursak; el yıkama, çapraz infeksiyonun önlenmesindeki en önemli adımlardan biridir. Uygun bir likid sabun ve dezenfektanla yapılan el yıkamasının eller üzerindeki geçici florayı %80, sonraki tekrarlanan yıkamalarda %90 oranında azalttığı bulunmuştur. Ellerdeki geçici mikrofloranın azalması, hekimden hastaya çapraz infeksiyonun geçme olasılığını azaltacaktır.
El Yıkama Teknikleri: Hasta bakımı ile ilgilenen bütün sağlık personeli için katı bir el yıkama kuralı getirilmelidir. Ellerdeki bütün yüzükler çıkartılmalı, tırnaklar ojesiz, kısa ve düz kenarlı olmalıdır. İkisi arasında mantar üreyebileceğinden takma tırnak kesinlikle kullanılmamalıdır. Önce eller ıslatılıp, az bir miktar antiseptik solüsyon alınıp ve fırçalanır. Kalabilecek antiseptik ajanlar cildi irrite edebileceğinden, akan su altında eller iyice yıkanır. Yeniden antiseptik solüsyon alınıp, 10 sn kadar eller ovuşturulur. Su ile durulama ve mümkünse kağıt havlular kullanılarak kurulanır. Tedavi esnasında eldiven kullanılması ikinci bir koruyucu önlem teşkil edecektir. Her hastadan önce ve yemek önceleri klinikten ayrılmadan önce ellerin yıkanması tekrarlanmalıdır.
Alet ve malzemelerin temizliÄźi
Dişhekimliğinde kullanılan aletler CDC (Center of Disease Control) tarafından 3 kategoriye ayrılmıştır.
1.Kritik aletler: Kan ile temas edenler. Yumuşak ve sert dokuya giren aletlerdir (Enjektör, bisturi, makas, kanal içerisinde kan ile temas eden bütün kanal aletleri). Her kullanımdan sonra mutlaka otoklav ile veya üst seviyede kuru-sıcak yöntemle sterilize edilip ambalajına konulup bu şekilde çöpe bırakılmalıdır. Bunun amacı, çöpün atılması ve taşınması sırasında görevlilerin infekte olma risklerini ortadan kaldırmaktır. Çöp atılırken bacağına enjektör batması sebebiyle infeksiyon hastalığına yakalanan personel rapor edilmiştir.
2.Yarı-kritik aletler: Kan ile temas etmeyen, ancak tükürükle, vücut sıvılarına, yumuşak ve sert dokuya temas eden aletlerdir (kan ile temas etmemişse, aeratör, angl-druva, frezler, devital kanal tedavisinde kullanılan kanal aletleri gibi) bozulabilmeleri ve yüksek seviyede sterilizasyona gerek göstermemeleri sebebiyle; her kullanımda mutlaka bir defa sterilizasyon işlemi gerekir. Bu sterilizasyon metodu, aletin bozulmayacağı en üst seviyede tutulmalıdır. Bu aşamada aletin kullanım kılavuzu dikkatle incelenmelidir. Eğer kimyasal metodlar kullanılacaksa aletlerin kimyasal madde ile en az 10 saat temas halinde kalması gerektiği, EPA (Environmental Protection Agency) tarafından önerilmektedir. Aerotör türbinleri için antiseptik spreylerde getirilmiştir. Ancak ne kadar faydalı olabileceği tartışılmalıdır. Bu aletler kullanıldıktan sonra en az 20-30 sn boşta çalıştırılmalı ve daha sonra sterilize edilmelidir. Bunda maksat, aletin su ve hava boruları içerisinde yer alan bakterilerin uzaklaştırılmasıdır. Aletin boşta çalıştırılması muayene odasında yapılıyorsa su spreyinin hemen önüne bir kağıt mendil konulmalı ve spreyin odanın havasına değil, mendil üzerine püskürtülmesi sağlanmalıdır. Bu kağıt mendil atılmalıdır. Bütün çöpler kalın torbalar içerisine konulmalı ve ağızları sıkıca kapatılmalıdır. Sıvı atıklar foseptiğe boşaltılmadan önce üzerine 50 ml/l %53’lük sodyum hipoklorit veya kireç kaymağı ilave edilmelidir. 3. Kritik olmayan aletler: Kan ve diğer vücut sıvılarına ve dokularına temas etmeyen aletlerdir. Bu tip aletler mukoza ve dişe temas etmezler. Röntgen tüpü, amalgamatör cihazı, hasta koltuğu vs. Bu tip aletlerin deterjan ve yıkama ile dezenfekte edilmelerine müsaade edilmektedir.
Suda kaynatma etkili bir yöntem olmayıp, sporları öldürdüğü kesin değildir. Bu nedenle sterilizasyon, bir dezenfeksiyon yöntemidir. Kuru hava fırınları (Pasteur) dişhekimliği muayenehanelerinde yaygın olarak kullanılır. Hava ısıyı kötü iletir. Bu nedenle yüksek ısıda daha çok bekletmek gerekir (170°C’de 1 saat). Daima geçerli olan kural, en güvenli sterilizasyonun otoklav olduğudur. En etkili sterilizasyon otoklavda yapılan nemli sterilizasyondur. İdeal basınç 1053 gr/cm2 ve ısı 121C’dir. Otoklavdaki maddelerin cinsi ve miktarına göre sterilizasyon süresi değişik olur genellikle süre en az 15, en çok 30 dakikadır. Sporlar dahil hiçbir mikroorganizma 121°C’daki buhara 10 dakika dayanamaz. Otoklavdaki sterilizasyonun yeterliliği Browne tüpleri ve özel kağıt striplerle kontrol edilebilir. Bu stripler, ticari olarak satılan Bacillus stearothermophilus ve Bacillus subtilis sporlarıdır. Her iki bakterinin de otoklav sterilizasyonunda kullanılabileceği ve aralarında hiç bir fark olmadığı gösterilmiştir.
Şırıngalar, iğneler, pansuman malzemesi, giysiler, önlükler, tüpler, besiyerleri otoklavda sterilize edilebilir. Sterilizasyon ve dezenfeksiyon öncesi aletler üzerindeki atıklar ve kalıntıların mekanik olarak uzaklaştırılması gerekir. Bu konuda spatüller, tel ve tahta fırçaları ve ultrasonik temizleyicilerden yararlanılabilir. Ultrasonik cihazlar, 20 kilohertz’den daha yüksek frekanslı ses dalgaları üreterek su dolu bir havuzun içerisine bırakılan el aletlerinin üzerindeki kalıntıları, hiç temasa gerek kalmadan uzaklaştırır. Çelik aletler, eğeler, pamuk pelletler, kağıt koniler kuru hava sterilizatöründe steril edilmektedir. Endodontik tedavilerde eğelerin sık kullanılışı, sterilizasyonda çabuk yöntemler gerektirir. Bu amaçla cam boncuk sterilizasyonundan yararlanılmaktadır (220°C’de 10 sn).
Resim 1
Sıcak yağ banyoları, piyasemen, angl-druva ve diğer başlıkların sterilizasyonunda kullanılmaktadır. Başlıklar önce çökelekleri uzaklaştırmak için temizleyici bir çözeltiye konur ve sıcak yağ sterilizatöründe 175°C’de 10 dakika tutulur. Her marka aeratörün nasıl sterilize edileceği prospektüsünde yazılıdır ve daima üretici firmanın talimatlarına uymak gerekir. Otoklavlama ile aeratörün hava yastığındaki fiber contaların hasar gördüğü düşünülüyorsa, aeratörler için antiseptik spreyler kullanılabilir. Aeratörlerin içerisinde kalmış mikroorganizmaları uzaklaştırmak amacıyla, her sabah çalışmaya başlamadan önce en az 30 sn boşta çalıştırılmalıdır.
Soğuk sterilizasyon bir dezenfeksiyon işlemidir ve sıcağa konamayan aletler için yararlanılmalıdır ve soğuk sterilizasyon yapılacak aletler önceden mekanik olarak iyice temizlenmelidir. Kullanıldıktan sonra atılan disposible gereçler her zaman tercih edilmelidir. Yüzeyler için sterilize edilebilen tepsi (paslanmaz çelik) sistemi tercih edilmelidir. Bu mümkün değilse tüm yüzeyler %70 izopropil alkol ile temizlenmelidir. Havlular ya kağıt olmalı veya kumaş ise çamaşır makinasında 90°C’lik ısıda yıkanmalıdır.
Guta-perka konlar standart yüksek ısılı sterilizasyon yöntemleriyle özelliklerini kaybetmediğinden, asepsinin sağlanması için kimyasal yöntemlere başvurulmaktadır. Bununla beraber birkaç kimyasal ajan, etkili, ucuz ve çabuk dezenfeksiyon sağlamaktadır. Gutaperka konlar için polivinilpirolidon-iyot kullanılması teklif edilmiştir. Bununda guta-perka konları dezenfekte ettiği, fakat sterilize etmediği görülünce %70’lik etil alkol, %50’lik metafen ve zefiran ile 15 dakika muamele edilmesi teklif edilmiştir. Bu işlem sporları öldürmeye yeterli olmamış, onun yerine guta-perka konların paraformaldehit buharları ile 3 saat veya formokrezol buharlarıyla 16 saat muamele edilmesi teklif edilmiştir. Daha sonra Savlon (klorheksidin glukonat %15+setrimid %1,5) ile iyi neticeler elde edilmiştir. Fakat daha sonra anlaşılmıştır ki, guta-perka konların en ideal ve hızlı dezenfeksiyonu sodyum hipoklorit ile mümkündür. Bacillus subtilis sporları ile kontamine edilen guta-perka konların sodyum hipoklorite 1, sporicidin ile 5, Cidex ile 15 dakika %99,90 düzeyinde dekontamine edilebildiği gösterilmiştir (Sporicidin ve Cidex glutaraldehit solusyonlarıdır). Bu çalışmaların sonuçlarına göre, guta-perka konların sterilizasyonunda NaOCI seçilecek solusyon olmaktadır. Bununla beraber glutaraldehit solusyonları alternatif antimikrobik madde olarak kullanılabilir. Aslında inert guta-perkanın bile çinko içeriğinden dolayı antibakteriyel aktivitesi bulunmaktadır. Ayrıca üretici firmalar guta-perkanın germisid aktivitesi olan türlerini yapmışlardır. Guta-perka konlara antibakteriyel özellik kazandırılması için vermillion ilavesi de yapılmıştır (vermillion civa oksit bileşiğidir).
Röntgen filimleri salya ile ve hatta bazen kan ile doğrudan temas eder. Bu sebeple kılıfları bol miktarda mikroorganizma bulundurur. Hasta ağızından çıkar çıkmaz her filim mutlaka önce akarsu altında bolca yıkanmalı ve daha sonra %5,25’lik NaOCI içerisine batırılıp çıkarılmalıdır. Daha sonra yeniden yıkanarak banyo edilmelidir. Metalik ve plastik ölçü kaşıkları her kullanımdan sonra fiziksel temizliği takiben otoklavlanmalıdır. Metalik olanlar, kuru sıcak sterilizatöre de konabilir.
Aeratör başlıkları: Zor temizlenebilen pek çok girintisi çıkıntısı olması dolayısıyla aeratörler, infeksiyon kontrolünde en zayıf noktalardan birini teşkil ederler. Son birkaç seneden beri yapılan aeratör başlıkları artık ısıya dayanıklı olarak imal edilip otoklav ve Pasteur fırınlarında steril edilebilirler ve yeni malzeme alımında mümkün olduğu kadar bunlar tercih edilmelidir. Aeratör başlıklarının ömürlerinin uzatılması için, yapımcıların önerilerine dikkat etmeli, tamire gönderirken veya tamirden geldikten sonra, mutlaka steril edip öyle kullanmalı, ayrıca sık sık, çok ince yağlarla yağlanmalıdırlar. Rutin tedavilerde, düşük riskli hastaların her tedavisinden sonra aeratör başlıklarının sterilizasyonuna gerek yoktur etkili bir dezenfektanla bunların üstlerinin dikkatlice silinmesi yeterlidir. Yüksek infeksiyon riskli hastalarda ise bunların mutlaka steril edilmeleri gereklidir. Ünitlerin su tanklarına, zaman zaman ileride bahsedeceğimiz dezenfektan bir solüsyonun konulmasıyla, bütün ünit su sistemi ile aeratör başlıklarının iç yapılarının dezenfeksiyonları sağlanmalıdır. Yukarıda belirttiğimiz üzere, yeni alet alımlarında mümkün olduğu kadar kuru hava ve otoklavla sterilizasyona dayanıklı aeratör başlıklarının alınmasına gayret edilmelidir.
Sprey tabancaları: Tükürük ve diş kirleri, devamlı olarak hava ve su tabancalarını kontamine etmektedir. Her diş kliniğinde bu tabancaların steril edilebilir en az üç ayrı başlığı bulunmalıdır. Bu başlıklar küvet içinde steril edilmeli ve özellikle yüksek infeksiyon riskli hastalarda her seferinde değiştirilmelidir. Yüksek emiş güçlü aspiratör başlıklarıda yarı kritik malzeme olarak kabul edilip, her hastadan sonra temizlenmeli ve disposible olanları kullanarak, ağızdan çıkanları atılmalıdır.
Ünit ve fotöy: Diş ünit ve fotöyleri kritik olmayan malzeme kabul edilip, her sabah temizlenmeleri yeterlidir. Üzerlerine disposible örtülerin örtülmesi dezenfekte edilecek yüzeyleri azaltacak ve işimizi kolaylaştıracaktır. Ülkemizde bu tür örtüler satılmadığından, havlu kağıt veya ince naylon örtülerin kullanılması aynı amacı sağlayabilir. Hastaların saçları arasında bulunabilen sayısız bakteri, yaslanma neticesi fotöyün baş konan yerine geçebilir. Dişhekimi veya yardımcısının bu bölgeye ellerinin teması ile, bu mikroorganizmalar tekrar hastanın ağızına veya bir başka hastaya bulaştırılabilir. Ufak bir plastik torba veya kağıt havlularla başlıkların katlanarak bunların sık sık değiştirilmeleri, bu kontaminasyon kaynağını elimine edecektir.
Reflektör ve reflektör kolları: Dişhekimliğinde kullanılan ışık kaynağı ve reflektörler asla dezenfektanlarla silinmemelidir. Dezenfektan solüsyonlar, reflektörün üst yüzeyinin kaplı olduğu kıymetli yansıtıcı yüzeyi zedeleyebilir. Mümkünse bunların koruyucu muhafazalı olanları alımlarda tercih edilerek rahatça dezenfekte edilmeli, diğer türlerin ise temizlenmesi kuru bezlerle yapılmalıdır. Reflektör kolları bir parça alüminyum foil veya plastik ile kaplanarak uygun bir dezenfektanla sık sık temizlenmelidir. Reflektör kolu, ünit ayar düğmeleri gibi düğmeler, %70’lik alkol içinde %0,5 oranında ilave edilmiş klorheksidin ile dezenfekte edilebilinir.
Ünitlerin küvet konulan kısımları, fotöy ayar düğmeleri ve kolları: Steril alet küvetlerinin üzerine konulduğu ünit kolları da yukarıda belirtilen şekilde, ya dezenfekte edilmeli, ya da üzerlerine kağıt peçeteler konulmalıdır. Yeni model elektrikli fotöylerin büyük bir kısmında, infeksiyon riskini azaltmak açısından ayak kontrolleri kullanılmaya başlanılmıştır. Ayak kontrolsüz pozisyon ayarlamalarında, el kontrolü düğmeleri tedavi esnasında bir örtü ile örtülmeli ve hasta aralarında dezenfekte solüsyonlarla temizlenmelidir.
Çelik veya elmas frezler: Bunlar yüksek seviyede dezenfeksiyona gereksinim gösteren yarı kritik aletlerdir. Tercihen Türkiye’de çok az kullanılan ultrasonik temizleyiciler ile temizlenmeli ve sterilizatöre ıslak halde konulmamalıdırlar. Her kullanımlarından sonra Pasteur fırınlarında steril edilmelidirler.
Pamuk ve tamponlar: Buhar veya kimyasal gazlarla steril edilen pamuk, pamuk pelet ve tamponlar ağzı kapalı cam veya metal muhafazalarda saklanmalıdır. İhtiyaç duyulan kadarları, el kullanmadan presel ile alınmalı ve kapakları derhal kapatılmalıdır.
Ünit kreşuarları ve irrigasyon solüsyonları: Ünit kreşuarları ayda bir kez yerlerinden çıkartılarak, dezenfektan solüsyonlarla silinmelidir. Steril haldeki irrigasyon solüsyonları ise kapakları bir kez açıldığında irrigasyon amacıyla maksimum bir hafta kadar kullanılmalıdır. Açıldıkları tarih, şişeler üzerine not edilmelidir.
Kauçuk malzeme : Isıya dayanıksız kauçuk malzeme, etilen oksid ile en iyi şekilde steril edilir. Hastanın ağzını kapatmaması için ağız içine yerleştirilen kauçuk ısırma blokları ile diğer bir kısım kauçuk malzeme sterilizasyonunda, buhar veya kimyasal gazlar kullanılır.
Septik materyalin ne yapılacağı
Hekimlerin çapraz infeksiyonları önlemedeki manevi sorumlulukları, hemen hasta tedavilerini tamamladıktan sonra bitmemektedir. Septik maddeler bütün yardımcı hizmet personelinin ve kliniklerin temizliğini yürütmekle görevli kişilerin sağlıklarını tehlikeye atmayacak tarzda ele alınmalıdır. Yüksek infeksiyon riskli hastaların tedavilerinden sonra, kullanılan bütün alet ve atık malzeme bir kağıda veya havluya sarılıp bağlanarak sterilizatöre konur. Bunları steril etmedeki amaç, biyolojik karakterlerini değiştirerek patojenitelerini azaltmaktır. Sterilizatörden çıkardıktan sonra diğer kullanılan malzeme gibi çöpe atılabilirler. Disposible maddelerde diğerlerine yapıldığı gibi atılmadan önce steril edilmelidir. Kullanılıp atılmayan havlu, önlük, bez, maske, kep gibi kumaşlar yanacakları veya renklerini değiştirecekleri için kuru ısı sterilizatörlerine konulmamalı, mümkünse otoklav edilmeli, aksi durumlarda iç içe girmiş iki ayrı torbaya konularak üzerlerine “kontamine madde” yazılarak büyük hastahanelerdeki merkezi çamaşırhanelere gönderilmelidir. Burada ve özel kliniklerin yıkama işleminin yapıldığı yerlerde, diğer çamaşırlardan tamamen ayrı olarak, daha fazla dezenfektan solüsyon ve deterjan kullanılarak yıkanmalıdır.
Resim 2
Enjektörler, iğneleri, sütür kancaları, bisturi uçları, endodontik aletler gibi sivri uçlu ve sivri kenarlı malzeme, diğer çöplerden ayrı bir yerde yırtılamayacakları mukavva, plastik veya metal kutularda biriktirilmelidir. Bazı özel durumlarda sanayii eldivenleri giyilmelidir. Hastahane ürünleri yakılıp yok edilmeli, iğneler ve cerrahi atıklar normal süprüntü ve atıklar ile karıştırılmamalıdır. ABD, İngiltere ve Almanya gibi ülkelerde yıllardan beri tıbbi infekte atıkları özel olarak hazırlanmış üzerleri, “infekte materyal” yazılı torbalarda toplanarak, belediyeler tarafından imha edilmektedir. Günümüzde de ülkemizin büyük şehirlerinde belediyelerimiz, gelen talepler doğrultusunda, muntazam aralıklarla, resmi-özel hastahane ve kliniklerin tıbbi infekte atıklarını özel araçlarla toplayarak imha etmektedir. Daha küçük yerleşme birimlerinde çalışan hekimlerimizin ise, bunları aynı şekilde apartman ısıtma kazanları veya soba gibi sistemlerde yakarak imha etmeleri gerekir.
DiĹź ĂĽniti su deposu
CDC’nin üzerinde önemle durduğu bir nokta, aerotörlerin su depolarının dezenfeksiyonudur. Ünitler üzerindeki su tankları, ml’de 200 koloni meydana getiren ünite (cfu/ml) bakteri içerebilirler. Bu sayı WHO’nun önerdiği normal orandır. Fakat bazı kereler bu ünit sistemlerindeki cfu/ml oranı, bir milyona kadar çıkabilecek derecede kontamine olmaktadır. Diş ünitleri su sistemleri şu iki kaynaktan yoğun olarak kontamine olurlar. 1) Şehir suyu şebekesinden direkt olarak gelen su yolu ile, 2) Bakterilerle kontamine olmuş, tükürük ve suyun, hasta üzerinde çalışırken hava, su püskürtme uçları ve aerotör başlıklarından geriye doğru kaçarak (suck back) ünit temiz su sistemine girmesi ve burayı kontamine etmesi ile. Mikroorganizmaların büyük bir kısmı da özellikle, immun baskılı bireylerde son derece tehlikeli olup, bu durum yeni ünitlerde geliştirilen bir vana “non retraction valve” sistemi ile önlenmiştir. Çünkü mikroorganizmalar diş üniti su sistemlerine bir kere girdiklerinde, ünit içindeki küçük su borucuklarında biyofilm meydana getireceklerinden eliminasyonları çok zordur. Biyofilm olgunlaştıkça, sudaki mantarlar, protozoanlar, nematotlar, ortama birikir. Protozoanlar, Legionella’lar için konak görevi görürler. Resim 3 Şehir içme sularının klorlu olmasında dahi, klorlu suyun ünitin ince su borucuklarında hareketsiz kalması durumunda klor etkisini kaybetmekte ve bakterilere tesirsiz kalmaktadır. Hafta sonları veya cihazın kullanılmayacağı uzun dönemler için depodaki su boşaltılmalı, depo bir dezenfektan ile yıkanmalı ve kurutulmalıdır. Çünkü bekleme ile depodaki suyun içerisindeki bakteriler çoğalabilmekte ve potansiyel bir infeksiyon kaynağı oluşturmaktadır. Diş ünitinin su deposunda bulunabilen bakteriler genellikle şu kontaminantlardır (Aeromonas, Plesimonas, Legionella, Rhodococcus, Pediococcus, Burkholderia, Pseudomonas, Haemophillus influenzae, Neisseria meningitidis, Bordetella pertusis, Streptococci, akuatik Mycobacterium’lar, mantarlar ve diğer akuatik parazitler ve hatta yosunlar). Ne kadar ilginçtir ki ; bu mikroorganizmalar yüzme havuzu ve akvaryum florasının üyeleridir. Bunlar insanda nadiren ölümle sonlanan hastalıklara sebep olurlar ve hastalık yapabilmeleri şahsın duyarlılığına bağlıdır. Fakat, bu durum dişhekimliği cihazlarının su depolarının dezenfekte edilmelerini engellemez. Su deposu içerisine %0,3 chlorhexidine katılması önerilmiştir. Su deposundaki suyun hastanın ağızına doğrudan geldiği için, hasta daha fazla risk altındadır. Bu su, aerosol haline geldiğinde, hastanın, dişhekiminin ve yardımcı personelin sağlığını tehdit eder. Diş ünitin su deposunda bulunan bakterilerin yaptıkları hastalıklar şunlardır:
Legionellozlar: Aerosoller ile bulaşabilecek hastalıkların başında Legionella pnömonisi gelir. Çünkü Legionella pneumophila diş ünitlerinin su depolarından en sık elde edilebilen bakteridir. Düşük ısıda ve metal tuzlarının varlığında daha kolay ve bol ürerler. Klima gibi ısıtma-soğutma sistemlerine, su depolarına, su birikintilerine yerleşebilmektedir. Lejyoner hastalığı adı ile bilinen bir akciğer enfeksiyonuna sebep olur. Bu hastalığın iki türlü kliniği vardır: birincisinde bulaşmayı takiben 2-10 gün kuluçka döneminden sonra ateş, kas ağrısı, kusma, taşikardi, ve geç dönemde balgam çıkarma, göğüs ağrısı, konvülsiyonlar ve delirium görülür. İkinci klinik formunda ise ateş yoktur, aslında belirgin pnömoni de yoktur. Bu klinik formun diğer adı; pnömonisiz pnömoni veya pontiac hastalığıdır. Kuluçka süresi 1-2 gündür. Hastada, kırıklık, halsizlik, başağrısı vardır, 2-5 gün bazen daha fazla devam eder. Bu tipteki lejyonellozların, canlı değil, çok sayıda ölü bakteri ile oluştuğu düşünülmektedir veya L.pneuomophila dışında başka Legionella’lar ile meydana geldiği zannedilmektedir. Dişhekimlerinde sık görülen tip budur ve muhtemelen diş ünitinin su deposundan bulaşmaktadır. Legionella’lar, bütün aldehitli dezenfektanlara, sodyum hipoklorite, dörtlü amonyum bileşiklerine, %70 etil alkole duyarlıdır. Diş ünitlerinin su deposundan yaygın olarak Legionella izole ediliyor olması gayet düşündürücüdür. Bu bakteri hastanın, dişhekiminin ve yardımcı personelin solunum yoluna yerleşmekte ve uzun süren subklinik enfeksiyonlara sebep olmaktadır. Yapılan bir çalışmada dişhekimliği ile ilgisi olmayan insanların serumlarında %5 oranında Legionella antikoru tespit edilmiştir. Aynı çalışmada dişhekimlerinin serumlarında %50 oranında, yardımcı personelin serumlarında %38, diş teknisyenlerinin serumlarında %20 oranında antikor bulunmuştur. Bu bakteriye karşı anlamlı miktarda antikor bulunması, bu insanların bu bakteriyle karşılaşmakta olduğu anlamına gelir. 15 Ağustos 1997’de Chicago’da bir Legionella salgını bildirilmiştir. Pnömoni sebebi ile ölen bir dişhekiminin otopsisinde akciğerde bol miktarda (105 CFU) L.dumoffi invazyonu tespit edilmiştir. Aynı bakteri, dişhekiminin kullandığı diş ünitinin su deposunda 102 CFU konsantrasyonda tespit edilmiştir. Su deposundan gelen ve aerosol içerisine karışan mikroorganizmalar ile tüberküloz dahil, bronşit, pnömoni ve benzer solunum yolu hastalıklarına yakalanmak mümkündür, muhtemelen dünyada pek çok dişhekimi bu haldedir. Su depolarının dezenfeksiyonuna daha fazla önem verilmelidir.
Ăśnit su sistemlerinde bakteri ĂĽremesinin engellenmesi
Ünit su sistemlerinde bakteri üremesini önleme bakımından, akşamları çalışma bitiminizde iki dakika veya hafta sonları üç-dört dakika boyunca, aeratör başlığı, su spreyi, kavitron gibi aletleri tam güçte bol su kullanılarak çalıştırın. Yapılan çeşitli araştırmalarda etki sırasıyla %10 lityum klorür, %0,5 povidon-iyot (Betadin), %5 sodyum klorür, %3 hidrojen peroksit, nitromersol (metaphen) %0,1 Lizol ve %0,3 konsantrasyondaki klorheksidinin ünit su sistemlerine konulması ile, bütün bakteri popülasyonlarında %95’e varan bir azalma görülmüştür.
Geri emme (suck-back) kontrolĂĽ
Halen kliniğinizde kullanmakta olduğunuz ünitin, günümüz standartlarına uygun geri emiş yapıp yapmadığını kontrol etmek ve ona göre önlem almak isterseniz: Bir bardak suyun içine 4-5 damla renk verici bir solüsyon damlatarak aeratör başlığınızı bu suyun içinde bir kaç dakika kadar yüksek devirde çalıştırın. Daha sonra çalışmayı durdurarak aeratör başlığını sudan çıkartmadan aynı bardak içinde 5 dakika tutun. Başlığı sonra boyalı sudan çıkartarak hafifçe kurulayın ve beyaz bir kağıt üzerinde reostaya yarım devir basarak çalıştırın. Renkli boya, kağıdı kirletiyorsa, geri emiş kuvvetlidir. Bu hatalı durumu düzeltmek için ünit su sisteminize geri emişi durdurma (anti suck-back) vanası koyun veya mevcut vananızı tamir ettirin.
Kaynaklar
1- Aydın M. Endodontik mikrobiyoloji. In: Alacam T. eds. Endodonti. Ankara: Barış Yayınları 2000: 313-385.
2- Challacombe HJ, Fernandez LL. Detecting Legionella pneumophila in water systems: a comparison of various dental units. JADA 1995; 126: 603-610.
3- Ciccio A, Chan EC. Elimination of microorganisms from dental operatory compressed air. J Can Dent Assoc 1998; 64 / 1: 42-49.
4- Cottone M, Terezhalmy O. Practical infection control in dentistry, 2nd edition, Elsevier 1996: 156-200.
5- Craig DC, Quale AA. The efficiency of face masks. Br Dent J 1985; 158: 887-892.
6- Külekçi G. Dişhekimliğinde infeksiyon kontrolü. Aktüel Tıp Dergisi 2002; 7/1: 66-73.
7- Larao R, Martin J. Dental room air. Prost. Dent. 1996; 116: 758-765.
8- Martin MV. Infection control in the dental environment. Cambridge: Martin Dunitz 1991: 5-90.
9- Mısırlıgil A. Dişhekimliği muayenehanelerinde enfeksiyondan korunma ve kontrol işlemleri. ORAL 1987; 4/37: 14-20.
10- Mısırlıgil A. Dişhekimliği tedavilerinde yüksek enfeksiyon riskli hastaların yönlendirilimi. ORAL 1987; 4/38: 12-15.
11- Mısırlıgil A. Dişhekimliğinde sterilizasyon için aletlerin hazırlanması ve en çok kullanılan kimyasal dezenfektan ajanlar. ORAL 1987; 4/39: 13-18.
12- Miller RI, Micik RE. Air pollution and its control in the dental office. Dent. Clin North Am 1996; 22: 454-460.
13- Mims,C.,et al: Medical Microbiology. 3rd. Edi. Elsevier-Mosby, 2006, 545-566.
14- Mutlu S, Porter S, Scully C. Dişhekimliğinde çapraz enfeksiyon kontrolü. İstanbul Er Ofset 1996; 1-77.
15- Ronald MA, Jefferey FW. Legionella contamination of dental unit waters. Appl Env Microbiology 1995; 61 / 4: 1208-1215.
16- Yılmaz GR, Çevik MA, Çetinkaya ŞY. Hastane infeksiyonlarının sürveyansı ve Amerika ulusal nazokomiyal infeksiyon sürveyans sistemi. Hastane İnfeksiyonları Dergisi 2002; 6/2: 55-71.
Prof. Dr. Dr. Aykut Mısırlıgil
Ankara' da 1949 yılında doğdu. İlkokul eğitimini Diyarbakır Ziya Gökalp İlkokulu' nda tamamladıktan sonra Diyarbakır Maarif Koleji' ne girdi ve 1968 yılında buradan derece ile mezun oldu. Aynı yıl, Ankara Üniversitesi Diş Hekimliği Yüksek Okulu' na girerek bu okuldan da 1973 yılında " üstün başarı " ile mezun oldu.
Ankara Üniversitesi Diş Hekimliği Fakültesinde 1974 yılında asistan olarak çalışmaya başlayan Dr. Aykut Mısırlıgil, Ankara Üniversitesi Tıp Fakültesi Mikrobiyoloji Kürsüsü' nde görevlendirildi ve İngiltere British Council bursunu kazanarak 1976 - 1977 yıllarında, Londra Eastman Dental Hospital ve Birmingam Dental Hospital' de doktora çalışmalarında bulundu. " Apikal granulomlu ve kistli dişlerde aerob - anaerob bakteriyolojik tetkikler " konulu teziyle 1978 yılında " Mikrobiyoloji doktoru " ünvanını aldı. 1984 yılında Tibbi Mikrobiyoloji bilim dalında, " Doçent ", 1990 yılında da " Profesör " ünvanını aldı. Aynı yıl Ankara Üniversitesi Sağlık Bilimlerine bağlı olarak, Ankara Üniversitesi Diş Hekimliği Fakültesi Diş Hastalıkları ve Tedavisi A.B.D' da 2. bir doktoraya başladı ve 1994 yılında da " Yeni bir örnek alma tekniği kullanarak çürüklü insan dişlerinin derin plak floralarının aerop ve anaerop olarak araştırılması " konulu teziyle bu doktorasını' da aldı.
1999 yılında da bir süre İngiltere, Scunthorpe - Goole hastahanalerinde çalışan, Türkiyenin Ağız Mikrobiyolojisi alanında ilk öğretim üyelerinden ve ilk diş hekimi kökenli Mikrobiyoloji Doçenti ve Profesörü olan Dr. Mısırlıgil, dünyanın 50' den fazla ülkesinde tıp ve diş hekimliği alanlarında incelemeler yapmıştır. Türk Diş Hekimleri Birliği, Türk Tabipleri Birliği, Ankara Diş Hekimleri Odası, Türk Mikrobiyoloji Cemiyeti, Ankara Mikrobiyoloji Derneği, Viral Hepatitle Savaşım Derneklerine üye olup, çeşitli tarihlerde ulusal ve uluslararası dergilerde yayınlanmış ve ödül kazanmış 100 civarında orijinal makalesi ve ayrıca ulusal ve uluslararası toplantılarda tebliğ edilmiş 50 bilimsel araştırması ve pek çok konferansı da bulunmaktadır.
Sanat Tarihi ve Arkeoloji ile ilgili yayınlar okumak, araştırmalar yapmak, kültür gezileri düzenlemek en büyük uğraşıdır. Bütün Türkiye üniversitelerinin bu konuda ki teki olan ve devamlı olarak öğrencilere, akademisyenlere , yurt içi ve dışı kültür gezileri düzenleyen, Ankara Üniversitesi Kültür Gezginleri'nin kurucusu ve koordinatörüdür. Prof. Dr. Zeynep Mısırlıgil ile evli olup, Dr. Mehmet Selçuk isminde bir oğlu vardır.
Resim 1: Legionella pneumophila kültürü: L. Pneumophila için örneklerden buffered charcoal-yeast extract (BCYE) besiyerine ekim yapılır ve normal atmosferde 2 haftaya kadar inkübe edilir. Kolonileri parlak, gri beyaz olup gram negatif çomaklardır (BCYE besiyeri, 37ºC de 4 gün).
Resim 2: Staphylococcus aureus. S. Aureus ile infekte bir yarası olan hastadan elde edilen kan kültürünün Gram boyaması. Gram pozitif koklar ve pembe renkli iltihap hücreleri.
Resim 3: Staphylococcus aureus. Kanlı agarda kültür. S. Epidermidis ve öteki koagülaz negatif stafilokokların aksine S. Aureus, tipik olarak, sarı ya da altın renkli koloniler oluşturur. (Kanlı agar, 37ºC’de 18 saat)
Ortodontide Sterilizasyon
Dt. Işıl ARAS, Prof. Dr. Ali Vehbi TUNCER
Bazı hastalıkların çapraz-enfeksiyon yolu ile yayılması ortodontik sterilizasyon ve dezenfeksiyona daha yakından bakılmasını gerektirmiştir.1 Dental kliniklere başvuran birçok HIV ve HBV taşıyıcısına teşhis konmadığından, hekim her hastanın potansiyel taşıyıcı olduğunu farz etmelidir. Buna göre bu problemle savaşmanın en iyi yolu gerekli önlemlerin etkili bir biçimde rutin olarak kullanımıdır.2
Ajan
Hastalık
Oda sıcaklığında
tahmini ömrü
Virusler
HAV
Hepatit A
Aylar
HBV
Hepatit B
Haftalar
Respiratuar virusler
Pnömoni, soğuk algınlığı
Saatler
Herpes simplex 1, 2
Cilt, ağız, göz ve genital enfeksiyonlar
Saniyeler-dakikalar
Mumps virusu
Parotitis
Saatler
HTLV-III
AIDS
HBVÂ’ den az
Bakteriler
Mikobakterium tĂĽberkĂĽlozis
TĂĽberkĂĽloz
GĂĽnler- haftalar
Stafilokok aureus
Cilt ve akciğer enfeksiyonları
GĂĽnler
Patojen streptokoklar
Akut tonsillofaranjit, kızıl
Saatler-gĂĽnler
Pnömöniak mikoplazma
AkciÄźer enfeksiyonu
Saniyeler-dakikalar
Treponema pallidium
Sfiliz
Saniyeler
Kirchoff ST. Sterilization in orthodontics. J Clin Orthod. May; 326-336, 1987
Mikroorganizma türlerinin sterilizasyon ve dezenfeksiyona karşı dirençlerine göre azalacak şekilde sıralanması: bakteriyel endosporlar (ör: tetanoz, şarbon) mycobacterium tuberculosis, ufak non-lipid virusler (ör: AIDS), mantar, orta büyüklükte lipid virusleri (ör: hepatit B), vejetatif bakteri (sfiliz ve kolera gibi hastalıklar; kızıldan impetigo’ya birçok hastalığa neden olan streptococcus pyogenes) şeklinde olmaktadır.3
Hasta bakım araçları (dental aletler, aygıtlar ve donanımlar) kullanım amaçlarına bağlı potansiyel enfeksiyon risklerine göre kritik, yarı kritik ve kritik olmayan aletler olarak üçe ayrılırlar. Ortodontide kullandığımız aletler yarı-kritik aletlere girer. Yarı kritik aletler mukozal membran ya da devamlılığı bozulmamış deri ile temas halindedirler4. Olayların normal seyri halinde bu aletlerin yüzeyleri ağzın mukozal membranını delmez.3 Bulaştırıcılık riskleri daha azdır.4 Bu aletler eğer sterilize edilemiyorsa yüksek seviyede dezenfekte edilmelidir.3
Canlı sporların temizleme ve durulamadan sonra el aletleri ve bantlar üzerinde kaldığı çok açıktır, yani estetiksel olarak temiz görünen aletler hala canlı mikroorganizmalar ile kontamine olabilir.5 Aletler sterilizasyona sokulmadan önce pas-inhibitörü içeren ultrasonik temizleyiciye yerleştirilmelidir. Ultrasonik solusyonlar hergün değiştirilmeli ve temizleme sırasında üstü kapanmalıdır ki aerosollar minimuma indirgensin. Aletler ve pensler ultrasonik temizlemeden sonra durulanmamalıdır.6 Ultrasonik yöntem temizleme için mükemmel iken, alet sterilizasyon işleminde son nokta olarak değerlendirilemez. Bazı klinik protokolleri el aletlerinin fırçalanarak temizlenmesini içerir. Fakat eğer ultrasonik sistem düzgün çalışıyor ise fırçalayarak temizlemeye gerek yoktur, çünkü zaten ultrasonikler bunun önüne geçmek için kullanılmaktadır.5
Sterilizasyon, fiziksel ya da kimyasal bir yöntem kullanarak, cansız obje ya da alet üzerindeki dirençli bakteri sporlarının da büyük bir bölümü dahil olmak üzere tüm mikroorganizmaların yok edilmesi, başka bir deyişle tüm yaşam formlarının tahribidir.3,4,7,8
Isıya dayanıklı dental aletler genelde 1) basınç altında su buharı (otoklav) 2) kuru hava ya da 3) doymamış kimyasal buhar ile sterilize edilir. Sterilizasyon Food Drug Association (FDA) tarafından onay verilmiş tibbi sterilizasyon gereçleri ile yapılmalıdır.4 American Dental Association (ADA)’ ın sterilizasyon için tavsiye ettiği yöntemler: otoklav, kuru hava, kimyasal buhar ve etilen oksit gazı’ dır.9 Bu metotların hepsi sporlar dahil olmak üzere mikroorganizmaları yok eder. ADA, aletlerin rutin sterilizasyonunda soğuk kimyasalların kullanımını tavsiye etmez çünkü solusyonun takibi ve kullanımı zor olabilir ve aletlerin steril pakete yerleştirilememesi yöntemin etkinliğini sınırlandırır.10
1) Otoklav (buhar sterilizasyonu):
250oC, 15 psi basınçta 15 dakikalık kullanım ile sonuç verir. Eğer basınç 30 psi, sıcaklık ise 270oC’ ye çıkarılırsa bu süre 3 dakikaya kadar düşer. İngiliz Diş Hekimleri birliği ideal otoklav uygulamasını 3 dakika boyunca 32 psi basınç ve 134oC sıcaklık olarak belirtmişlerdir.11 Kullanılabilecek diğer sıcaklıklar 126oC’de 10 dakika, 121oC’de 15 dakika, 115oC’de 30 dakikadır. Süre alet miktarına, konteynır tipine, poşetleme kullanılıp kullanılmadığına ve otoklav içindeki sıcaklığa bağlıdır.3
Drake’e göre otoklav diğer metotlardan daha üstün sterilizasyon sağlamakta, alet döngüsü daha çabuk olmakta ve paslanma kontrol edildiği sürece kesici kenarlar üzerinde daha az koroziv etki göstermektedir.6 Otoklavın nemi ve ısısı karbon çelik aletlerin korozyonuna ve matlaşmasına, lastiklerin ve plastik aletlerin zayıflamasına neden olur.3 (Resim1)
2) Kuru hava sterilizasyonu:
Otoklava göre çok daha yüksek sıcaklık ve zamana ihtiyaç vardır.3 Nemli hava sterilizasyonu ile zarar görebilecek materyallerde kullanılır. Avantajları ucuz olması ve koroziv olmamasıdır.4 Fakat iki tane önemli dezavantajı vardır: Birincisi 150oC- 160oC’ de 1 ile 2 saat arası zaman gerektirir. Buna işlemin başında ısınması için geçen süre ve sonunda da soğuması için geçen süre de eklenince tam bir döngünün tamamlanması uzun süre alır. İkincisi ise havanın bazen sterilizatör içerisinde tabakalaşması böylelikle de sirkülasyonun zayıf olmasına bağlı olarak eş olmayan sıcaklıklara neden olup sterilizasyonu engellemesidir.3,7,8
Lastik ve plastik materyaller yüksek ısılardan zarar görebilir. Karbon çelik aletler ise tekrarlayan yüksek ısı nedeni ile kırılganlaşabilirler. Aletler haftada en az bir kere saf silikon ile yağlanmalıdır; bu işlem için yağ kullanımından kaçınılmalıdır çünkü yağlar; üzerinde bakteri biriktirebilir ve ısı iletimini etkileyebilir.12 Diğer sıcaklık kombinasyonları 160oC’de 2 saat, 170oC’ de 1 saat, 180oC’de yarım saattir.3
Forced-air tipinde ise, ısıtılmış hava aletlere daha hızlı şekilde enerji transferini sağlayacak biçimde konteynırın içinde yüksek hızda sirküle olur böylece de sterilizasyon süresi kısalır.4 Günümüzdeki rapid-airflow teknolojisi ile 190.56oC sterilizasyon zamanı 6 dakikaya kadar inmiştir.12 (Resim2)
3) Doymamış Kimyasal Buhar:
%0.23 formaldehit içeren birincil dereceden alkolden oluşan kimyasal solüsyonun (formaldehit, alkol ve su7) basınçlı bir konteynırda ısıtılmasından oluşur.4 132.2oC’ lik ısı, 20-40 psi basınçta 20 dakika uygulanır.7 Karbon çelik aletlerin doymamış kimyasal buhar ile sterilizasyonu otoklava göre daha az korozyona neden olur çünkü döngüde daha az su bulunur. Aletler sterilizasyona sokulmadan önce kurulanmalıdır.4 Süreç ortodonti kliniği için pratik olsa da, kimyasal kokusu zararlı olmamasına rağmen iyi bir ventilasyonu gerekli kılar.3,8 (Resim3)
4) Hiperbarik Gaz:
Etilen trioksit gazı (ETO) kullanılır. Metal olmayan, ısı ve nem uygulamasından zarar görebilecek, korozyona uğrayabilecek aletler için uygulanır.7 10–48 saatlik sterilizasyon süresi, hastalara zarar verme potansiyelinden dolayı katı sağlık ve güvenlik önlemleri gerektirmesi, bu yöntemi özel klinikler için pratik olmaktan çıkarır. Bu yöntemler oda sıcaklığında 12 saat, 56oC’ de ise 4 saatte sterilizasyon elde edilir. Turlu aletler bu yöntemle etkili bir biçimde sterilize edilemezler çünkü ETO gazı ufak lumenden azalmış bir oranda geçer. Düşük ısı sterilizasyonun diğer tipleri (ör: hidrojen peroksit gaz plazma) de vardır fakat dental klinikler için pratik değildir.3
5) Glass Bead Sterilizasyon:
1.2-1.5 mm çaplı silika boncuklarıyla dolu olan izole edilmiş bir kap ve ısıtıcı bir üyeden oluşur.3,4 Uygulama sıcaklığı 217-232oC arasında değişir.4 Boncuklar sterilize edilecek aletlere destek sağlamanın yanında ısıyı tutar ve eşit dağılmasını sağlar. Üreticinin tavsiye ettiği süre kadar sterilizatörde bırakılmalıdır, genelde 218oC’ de 20 saniyedir.3
Smith’in Baciluus subtilis sporları ve Staphylococcus albus bakterisi ile inokule ettiği bantlar üzerinde yaptığı çalışmada sporlar için 45 saniye, bakteriler için 15 saniyelik sürecin sterilizasyon için yeterli olduğu belirtilmiştir. Fakat bu yöntem bantlar gibi küçük materyallerle sınırlı kalmış ve büyük aletlerin sterilizasyonunda yeterli olmadığı belirtilmiştir.13 (Resim4)
6) SoÄźuk Sterilizasyon:
Kullanılan ürünler, gluteraldehit, fenollu gluteraldehit, hidrojen peroksit, perasetik asitli hidrojen peroksit ve perasetik asittir.4 Isıya duyarlı kritik ve yarı kritik aletler ve araçlar (dudak, dil retraktörleri, fotoğraf aynaları, bant-çıkarıcı pensler) %2’ lik gluteraldehit solusyonu gibi FDA tarafından sterilizan olarak onay verilmiş sıvı kimyasal germisitler içine daldırılarak sterilize edilebilirler.1,4,14
Gluteraldehit mikropların protein yapısında bulunan amino asit yapısını bozarak etki eder. 1) solusyondan çıkarıldıktan sonra toksik ve irritasyona neden olan tortuların uzaklaştırılması için steril su ile yıkanmaları gerekir 2) steril eldivenlerle ellenmeleri ve steril havlularla kurulanmaları gerekir 3) kullanım yerine aseptik olarak taşınmaları gerekir 4) Yaklaşık 12 saat süre ile solusyon içinde bırakılmaları gerekir. Tüm bu nedenlerden dolayı neredeyse hiçbir zaman sterilizan olarak kullanılmazlar. 12-90 dakika uygulama ile genelde yüksek seviyede dezenfektan olarak kullanılırlar. Sterilizasyon ve yüksek seviyede dezenfeksiyon arasındaki tek fark sıvıda bırakıldığı süredir. Kokusu rahatsız edici gelebilir ve irritasyona neden olabilir bu yüzden kapalı bir kapta bulundurulması ve kliniğin iyi havalandırmaya sahip olması tavsiye edilir. Alet yüzeylerinde matlaşma ve korozyona neden olabilir.3 1991 yılında Jeffries ve ark.nın yaptığı çalışmada soğuk sterilizasyonun elastik zincir üzerindeki etkisi incelenmiş ve klinik kullanımda herhangi yıkıcı etkisi olmadığı görülmüştür. Uzun süre (144 saat) gluteraldehit solusyonunda bekletilmiş elastik zincir ile 500g kuvvet elde etmek için gereken deplasman en fazla 5 mm artarken zinciri koparmak için gerekli kuvvet sadece 20-100 gram azalmıştır.15
Alkolun ise Centers for Disease Control and Prevention (CDC) tarafından yüzey dekontaminasyon yöntemlerinden biri olarak kabul edilemeyeceği belirtilmiştir.4 Etil ve izopropil alkol bakteriel sporlara karşı etkisizdir, viruslere karşı değişken etki gösterir, geride herhangi etki bırakmadan çabucak buharlaşır ve organik materyal ile inaktive olur.3 Molinary ve ark.nın yaptığı çalışmada ise kan ve organik artıkların el aletleri üzerinden temizlenmesinde sadece suyun alkolden daha iyi olduğu ve el aletleri üzerinden tükrüğü uzaklaştırmada alkole güvenilemeyeceği belirtilmiştir.16 1990 yılında Cash ve ark.nın yaptığı çalışmada da el aletlerinin sterilizasyonu ve dezenfeksiyonunda alkol kullanımının 1988’ e göre değişmeden kaldığı, pensler için önemli oranda düştüğü, turlu aletlerde ise hafif bir düşüş gösterdiği belirtilmiştir.1
Pensler ve Sterilizasyon:
Ortodontik aletlerin temizlenmesi ve sterilizasyonu özel problemler doğurur. Ortodonti camiasında ortodontik penslerin sterilizasyonunda tercih edilen yöntem üzerinde tartışmalar olmuştur. Bu aletlerde temizlenmesi ve sterilizasyonu zor olan geniş menteşe bölgeleri vardır. Bunlara ek olarak kesici kenarları, keskin açıları ve sivri uçları kolayca zarar görebilirler. Ayrıca, klinik uygulamada, temizleme ve işlem görme sırasında elde olmayan hasarlar oluşması önemli bir ekonomik problemdir çünkü ortodontik aletlerin tamiri ve yenilenmesi pahalıdır.5
Ortodonti kliniklerinde genelde kuru hava sterilizatörleri tercih edilir çünkü otoklav buharındaki nem, korozyon ve aletlerin hızla bozulmasına neden olabilir. Matlack otoklavın ortodontistler tarafından kabul edilemeyeceğini çünkü penslerin menteşe bölgelerinde ciddi paslanma ve korozyonlara neden olduğunu belirtmiştir. Diğer yazarlar ise kuru hava sterilizasyonunun hassas kesici yüzeyleri koruduğunu belirtir. Yakın zamana kadar aletlerin paketlenememesi kuru hava sterilizasyonunun dezavantajı olarak kabul edilirdi.10
1994’te Mazzocchi ve ark.nın çalışmasında, otoklavlama, kuru hava ve kimyasal sterilizasyonun 500 döngülük kullanımında ligatur kesici ve distal kesicilerde yüzey renginde bozulma, kararma ve sertlik üzerindeki etkileri incelenmiştir. Sertlikteki en fazla artış otoklav uygulanan, en az ise kuru sterilizasyon uygulanan distal kesicilerde görülmüştür. Yüzey rengindeki bozulma en fazla kimyasal sterilizasyon olmak üzere her grupta görülmüştür. Gene de çalışma sonucunda her 3 grupta da 500 döngülük sterilizasyondan sonra meydana gelen klinik ve metalurjik modifikasyonlar göz ardı edilebilecek kadar azdır.17
Aletlerin uzun ömürlü olmasını etkileyen en önemli faktörler temizleme ve yıkamada özen gösterme, sık yağlama ve temizleme/sterilizasyon süresince yeteri kadar kuru olduğundan emin olunmasıdır.2
1998’ de Davis ve ark. yaptığı çalışmada son 10 yılda diş hekimlerince sterilizasyon metotlarının dezenfeksiyona oranla bariz olarak daha fazla kullanıldığını belirtmişlerdir. Son yıllarda el aletleri, pensler ve turlu aletlerde soğuk dezenfeksiyon kullanım oranının azaldığı, otoklavın ise kullanım oranının arttığını belirtmişlerdir. El aletleri ve pensler için kimyasal sterilizasyon oranı aynı kalırken kuru sterilizasyon dramatik bir artış, turlu aletlerde ise orta seviyede bir artış göstermiştir.18
Otoklavın neden olduğu problemlere karşı daha yüksek oranda paslanmaz çeliğe sahip alet kullanılması ve aletlerin %1’lik sodyum nitrat solusyonuna batırılması korozyon ve matlaşma sorunlarını çözebilir.19
Teller ve Sterilizasyonu:
Geçmişte birçok ortodonti kliniği pensler, teller ve diğer ortodontik malzemeler için soğuk sterilizasyonu tercih etmiştir. Fakat genelde aletler sterilizasyon yerine (10.5 saat) sadece dezenfeksiyona yetecek kadar (birkaç saat) solusyonda bırakıldığı için bu standart değişmiştir.20
TMA teller, SS tellere göre yaklaşık üç kat, NiTi teller ise iki kat daha pahalıdır.20 Bu yüzden eğer teller yeniden kullanabilirlerse ekonomik yararlar sağlarlar. Ark tellerinin yeniden kullanabilirliği hem korozyon gibi intraoral etkilerden hem de sterilizasyon işleminden etkilenir.21Ayrıca bazı yazarlara göre sterilizasyon, yüzey sertliğinde değişmeler, renk bozuklukları, kontaminasyon ve hücrelerin tel yüzeyine daha az tutunması gibi etkilere neden olabilir.22
Smith ve ark.nın yaptığı çalışmada NiTi tel, β-titanyum tel ve paslanmaz çelik tellere klinik kullanımdan sonra sadece dezenfeksiyon veya dezenfeksiyonla birlikte otoklav, kuru hava ya da soÄźuk sterilizasyon yöntemleri uygulanmıştır. Bu iĹźlemlerden sonra yĂĽk/defleksiyon, gerilim testleri ve korozyon potansiyeli araĹźtırılmış ve araĹźtırma sonucunda kliniksel olarak önemli bir fark bulunmazken NiTi tellerin en az bir kez yeniden kullanılabileceÄźi belirtilmiĹźtir.21
Staggers ve ark.nın yaptığı çalışmada ise, 0.016” β-Ti, NiTi ve SS tellerin azami dayanıklılık sınırı ĂĽzerinde beĹź döngĂĽlĂĽk kuru hava, otoklav ve etilen oksit sterilizasyonlarının etkileri incelenmiĹźtir. TMA telin kuru hava ile sterilizasyonunun ilk döngĂĽsĂĽ sonunda azami dayanıklılık sınırında önemli derecede artış olurken beĹź döngĂĽ sonunda fark bulunmamıştır. Otoklavlama ve etilen oksit sterilizasyonu ise dayanıklılık sınırında herhangi fark yaratmamıştır. NiTi tellerde ise kuru hava ve otoklav sterilizasyonu birinci döngĂĽ sonunda yine dayanım sınırını artırırken beĹź döngĂĽ sonunda fark olmamıştır. NiTi tellerde ise etilen oksit sterilizasyonundan sonra herhangi bir fark olmamıştır. SS tellerde ise üç sterilizasyon yöntemi sonucu herhangi bir fark bulunmamıştır. Dayanıklılık sınırındaki deÄźiĹźiklikler telin klinik kullanımını etkiler. EÄźer telin azami dayanıklılık sınırı azalırsa kırılmaya daha meyilli hale gelir.20
Crotty ve ark. 140 adet .016”x.022” superelastik NiTi telleri biri kontrol olmak üzere 7 gruba ayırmışlardır. Diğer gruplar; 32 lb/in2 132oC’ de bir otoklav döngüsü, 32 lb/in2 132oC’ de 2 otoklav döngüsü; 1x3 saatlik, 2x3 saatlik, 1x24 saatlik, 2x24 saatlik %2’ lik gluteraldehit solusyonudur. Yapılan çalışma sonucunda güncel olarak kabul edilen çapraz enfeksiyon kontrol işlemlerinin tellerde klinik yükleme, azami dayanıklılık sınırı ya da bükülme katılığı üzerinde bir fark yaratmadığı belirtilmiştir.1
2005 yılında Pernier ve ark. yaptıkları çalışmada; paslanmaz çelik tel, şekil hafızalı NiTi, TMA ve Low Friction TMA tel gruplarının 18 dakika 134oC’ de otoklavda sterilizasyonu sonucu tellerin yüzey parametreleri ya da mekanik özellikleri üzerinde istenmeyen bir etkiye neden olmadığını belirtmişlerdir.22 (Resim7)
Kaynaklar
1. Robert G.Cash: Trends in sterilization and disenfection procedures in orthodontic offices. Am J Orthod dentofac orthop 1990;98:292-9
2. Malcom Jones, Kevin Pizarro, Romalo Blunden: The effect of routine steam autoclaving on orthodontic pliers. European J Orthod 15(1993) 281-290
3. David Croser, John Chipping: cross infection control in general dental practice. Quintesessence publishing co.ltd.,London UK 1989
4. Centers for Disease Control and Prevention (CDC): Guidelines for Infection Control in Dental Health-Care Settings. December 19, 2003 / Vol. 52 / No. RR-17
5. W.F. Hohlt, C.H. Miller, J.M. Neeb, M.A. Sheldrake: Sterilization of orthodontic instruments and bonds in cassettes. Am J Orthod Dentofac Orthop 1990;98:411-6
6. D.L. Drake: Optimizing orthodontic sterilization techniques. JCO 1997;31: 491-498
7. Uzel i, Haydar B. Klinik ortodontide sterilizasyon ve dezenfeksiyon. TĂĽrk Ort Der. 2 (2); 328-333, 1989
8. G.S. Payne: Sterilization and disinfection in the orthodontic office: A practical approach. Am J Orthod Dentofac Orthop 1986;3: 250-252
9. Council on Dental Materials, Instruments, and Equipment, Council on Dental Practice, and Council on Dental Therapeutics.Infection control recommendations for the dental office and the dental laboratory. J Am Dent Assoc 1996;127:672-80.
10. Ricardo J. Vendrell, ,a Curtis L. Hayden, and Louis J. Taloumis: Effect of steam versus dry-heat sterilization on the wear of orthodontic ligature-cutting pliers
11. O.P.Crotty, E.H.Davies, S.P.Jones: the effects of cross-infection control procedures on the tensile and flexural properties of superelastic nickel-titanium wires. British J Orthod 1996(23): 37-41
12. George Carcao: Comparison of Three Dry-Heat Convection Sterilizers JCO Volume 1993 May(259 – 263)
13. Gerald E. Smith: Glass bead sterilization of orthodontic bands. AJO-DO Volume 1986 Sep (243 - 249)
14. Campbell PM, Phenix N. Sterilization in the orthodontic office. J Clin Orthod. Oct. 684-686, 1988
15. C.L. Jeffries: The effects of 2% alkaline gluteraldehyde solution on the elastic properties of elastomeric chain, Angle Orthodontist 1991 No. 1, 25 – 30
16. Molinari JA: Comparisons of dental surface disinfectants. Gen Dent. May-June 1987
17. Alberto R. Mazzocchi , Corrado Paganelli,Carlo M Effects of Three Types of Sterilization on Orthodontic Pliers: JCO, Volume 1994 Nov(644 - 647)
18. D.Davis, E.A.BeGole: Compliance with infection-control procedures among Illinois orthodontists. Am J Orthod Dentofacial Orthop 1998; 113:647-54
19. Youngblade, Meyers, and Hondrum: Prebagging instruments for rapid head transfer sterilization. AJO-DO Volume 1994 Dec (627 - 634)
20. J.A.Staggers, D.Margeson: the effects of sterilization on tensile strength of orthodontic wires. The Angle orthodontist 1993(63); 141-144
21. .Smith, J.A. von Fraunhofer, G.R.Casey: the effect of clinical use and sterilization on selected orthodontic arch wires. Am J Orthod Dentofac Orthop 1992;102:153-9
22. .Pernier, B.Grosgogeat, L.Ponsonnet, G.Benay, M.Lissac: influence of autoclave sterilization on the surface parameters and mechanical properties of six orthodontic wires. European J Orthod 27 (2005) 72-81
Prof. Dr. Ali Vehbi TUNCER
29 Nisan 1954 tarihinde Nazilli’ de doğdu. İlk, orta ve lise eğitimini İzmir’ de tamamladıktan sonra 1972 yılında Ege Üniversitesi Dişhekimliği Fakültesi’ ne girdi ve 1977 yılında mezun oldu. 1978 tarihinde Ege Üniversitesi Diş Hekimliği Fakültesi Patoloji Kürsüsü’ ne asistan olarak girdi. 1982’ de doktora tezini tamamladı. Gülhane Askeri Tıp Akademisi’nde askerlik görevini tamamladıktan sonra 1985 tarihinde E. Ü. Dişhek. Fakültesi Ortodonti Anabilim Dalı’ na girdi. 1988’ de Ortodonti Uzmanı, 1991’ de Yrd. Doç, 1993’ te Doçent ve 2000 yılında ise Profesör ünvanını aldı. Halen Ortodonti Anabilim Dalı’ nda öğretim üyesi olarak çalışmaktadır.
Dt. Işıl ARAS
14 Ocak 1982 tarihinde İzmir’ de doğdu. İlk, orta ve lise eğitimini İzmir’de tamamladı. Yüksek öğrenimini 2001–2006 yılları arasında Ege Üniversitesi Dişhekimliği Fakültesi’nde tamamladı. Aynı yıl Ege Üniversitesi Dişhekimliği Fakültesi Ortodonti Anabilimdalı’nda doktora programına kabul edildi. Halen doktora eğitimine devam etmektedir.
Ağız Gargaraları
Prof.Dr.Meral ĂśnĂĽr
Ağız gargaralarının tıbbi amaçla kullanımlarına ilk kez M.Ö. 2700’ de Çin’ de rastlanır. Bu tarihten sonra pek çok farklı coğrafyada betel yaprakları, kafur, kakule ve diğer otlar, değişik tuz karışımları, sirke, anason, dereotu ve beyaz şaraptan yapılmış ağız gargaralarının, nefes açıcı, tedavi edici ve antiseptik olarak kullanıldığı bilinmektedir. Yüzyıllardır tedavi ve kozmetik amacıyla kullanılan bu ajanlar ancak son yıllarda bilimsel araştırmalara konu olmuş, bu sayede klinikte ve günlük oral hijyen uygulamalarında yer almıştır. Günümüz modern dişhekimliğinin rutin olarak kullandığı ağız gargaraları koruyucu ve tedavi edici özellik taşırlar. Başlıca kullanım alanları diş çürüğünün önlenmesi ve gingivitis tedavisi olmakla beraber; ortodonti, kuron köprü ve implant hastaları, periodontal cerrahi veya intermaksiller fiksasyon yapılan cerrahi işlemler sonrasında, hiperplazi, kserostomi, kandidiazis, mukozit varlığında, bakteriyemi ve infeksiyon riski taşıyan hastalar için farklı özellikteki ağız gargaraları önerilmektedir. Antifungal özelliği bulunan ağız gargaraları özellikle immun sistemi baskılayıcı ilaçlar kullanan hastalara tıp hekimleri tarafından destek tedavi olarak ve AIDS hastalarında da oral kandidiazisin önlemek için kullanılmaktadır. Antimikrobiyal ağız gargaraları ise bakteriyel endokarditin profilaksisi için de önerilmektedir. İmmun sistemi baskılayıcı tedavi, baş-boyun bölgesine radyoterapisi ya da kemoterapisi gören hastalarda tedavilerin yan etkisi olarak mukozit gelişir. Bu hastaların ağız sağlığını koruyabilmeleri ve normal yeme alışkanlıklarını sürdürebilmeleri antimikrobiyal ağız gargaraları kullanmaları ile sağlanır.
Pek çok farklı kullanım alanı ile hayatımıza giren ağız gargaralarının sayıları her geçen gün yapılan klinik ve laboratuar çalışmalarla daha da artmaktadır. Bu nedenle yazımızda dişhekimliğinde ve tıbbın pek çok alanında kullanılan ağız gargaralarının kullanım alanları, çeşitleri, yan etkileri ve özellikleri ile ilgili en son yaklaşımları ve bilgileri tekrar gözden geçirmeyi amaçladık.
Ağız gargaralarının kullanım alanları:
Dişhekimliği kliniğinde sıklıkla kullanılan antimikrobiyal ağız gargaraları oral kavitedeki mikroorganizma sayısını azaltmayı hedefler. Örneğin sık karşılaşılan problemlerden biri olan halitozisin önlenmesinde kullanılır. Ağız gargaraları, dişhekimliği işlemlerinde yüksek devirli aletler ya da ultrasonik küretaj aletlerinin kullanılması sırasında oluşan aerosoldeki bakteri sayısını azaltmak için de kullanılır. Bu amaçla hastalar işlem öncesi ya da işlem sırasında ağızlarını antimikrobiyal bir gargara ile çalkalarlar. Aerosol oluşumunun azaltılması uyulması gereken enfeksiyon kontrol işlemlerinden biridir.
Antimikrobiyal ağız gargaralarında kullanılan etken maddeler arasında klorheksidin ilk sıradadır. Plağa bağlı bakteri oluşumunu azaltan etkileri nedeniyle gingivitis ve periodontitisin tedavisinde kullanılır. Ağız gargaraları arasında in vivo ve in vitro yapılmış çalışmalarda kimyasal plak kontrolünde klorheksidinin tercih edildiği pek çok sayıda literatür belirtilmiştir.
Diğer içeriklerdeki ağız gargaraları ayrıca ülserasyonların semptomatik tedavisinde, kandida enfeksiyonlarının tedavisinde ve oral enflamasyona bağlı ağrının önlenmesinde de kullanılmaktadır.
Sodyum florid içeren ağız gargaraları daha çok minesinde porozite olan çocuklarda ve yüksek çürük riski olan erişkinlerde önerilmektedir. Dental hipersensitiviteye bağlı rahatsızlıkların giderilmesi tedavisindeki prensip, potasyum nitrat ve sodyum floridin farklı konsantrasyonlarda kullanımına dayanır.
Bu gargaraları kullanacak kişilerinin hangi gargarayı ne için kullanacağını çok iyi bilmesi gerekmektedir.
Ä°SÄ°M
AÇIKLAMA
Antimikrobiyal ajanlar
Bakterisid ya da bakteriostatik etkili olan kimyasallar
Plak azaltıcı/önleyici ajanlar
Plak miktarı ve etkisini azaltan kimyasallar
Antiplak ajanlar
Gingivitis ve çürükte oluşan plak üzerine etkili olan kimyasallar
Antigingivitis ajanları
Antiinflamatuar ajan içeren ve gingival inflamasyonu engelleyen kimyasallar
Antiperiodontitis ajanları
Subgingival biofilme karşı etkili olan kimyasallar
Tablo 1 : Oral hijyen ürünleri: Açıklamaları ve klinik etkileri.
Ağız gargaralarının yan etkileri:
Ağız gargaralarının en sık rastlanan yan etkisi, içeriğindeki alkole bağlı gelişen problemlerdir. Yüksek dozdaki etanolün pH değeri düşüktür ve gargaranın içeriğindeki doğal tatlandırıcılar veya lezzet verici maddeler potansiyel olarak bazı hastalar için irritan olabilirler veya sinerjik etki gösterebilirler. Alkolün ayrıca toksik etkisi vardır ve oral kavitedeki dokulara zarar verebilir. Alkol oranı % 25 veya daha fazla olan gargaraları kullanan bireylerde epitelde ataşman kaybı, mukozal ülserasyon, gingivitis ve peteşiler görülebilir. Laboratuar hayvanlarında ve insanlarda ağız mukozasında yapılan uzun dönem çalışmalarda alkol içeren ağız gargarası kullanımına bağlı olarak ağız mukozasının farklı bölgelerinde beyaz lezyonların çıktığı gözlemlenmiştir.
Ağız gargaralarında bulunan ve bazen de su ile karıştırılarak kullanılan gargaralardaki etanol ağız içerisinde ağrıya sebep olabilir. Ağrının şiddeti gargaranın kullanım süresine bağlıdır ve içerisindeki etanol miktarı ile doğru orantılıdır. Etanolün % 10’un altında olduğu durumlarda genellikle önemli ağrı hissi oluşmaz.
Ağız gargaraları aynı zamanda erken ve geç dönem kullanımına bağlı olarak sistemik alerjik reaksiyonlara neden olabilir. Bazen minede demineralizasyona ve dişlerde boyanmaya da neden olabilir. Benzidamin ağız gargarası ise kırmızı döküntülere sebep olabilir.
Bilimsel platformda listerin gibi yüksek oranda alkol içeren ağız gargaralarının oral kanserler risk faktörü olup olmadığı halen tam olarak açıklığı kavuşmamıştır.
Ağız gargaraları üzerine yapılan çalışmalar:
Ağız gargaraları üzerine yapılmış pek çok kısa dönem çalışmalar arasında Breck ve ark. Listerin, meridol ve klorheksidinin anti-plak, anti-gingivitis ve antimikrobiyal etkileri üzerine yaptıkları çift-kör karşılaştırmalı bir çalışma da yer alır. Meridol, amin florid ve kalay florid karışımı bir ajandır. Profesyonel diş taşı temizliği sonrası 36 hasta 21 gün boyunca günde iki defa oral hijyen ölçümleri için bu üç gargaradan birini kullanmış veya plasebo ile gargara yapmışlardır. 3 haftanın sonunda klorheksidin kullanan grupta en az plak miktarı ölçülmüş, buna karşın listerin ve meridol kullanan gruptaki plak seviyesi placebo grubuna yakın ölçülmüştür. Listerin ve meridolün plak üzerindeki etkilerinin azalması ancak üç haftada gözlemlenmiştir. Klorheksidinin plaseboya oranla gingivitis üzerine % 50 oranda daha fazla etkili olduğu buna karşın listerinin ve meridolün gingivitis üzerine kontrol grubu ile kıyaslandığında anlamlı bir sonuç elde edilemediği bildirilmiştir. Yapılan boyama testinde ise klorheksidinin mikroorganizmalar üzerinde en etkili olduğu bunu sırasıyla meridol ve listerinin izlediği görülmüştür.
Ağız gargaraları üzerine yapılmış pek çok uzun dönem çalışma arasında Minah ve ark.’nın 83 hastada 6 ay boyunca günde iki kez Listerin kullanımının plak florası üzerindeki etkilerini inceledikleri araştırma da yer alır. Araştırma sonucunda Spiroketler, siyah-pigmente bacteriodes, Streptococcus Mutans veya Candida Albicans sayılarında anlamlı bir artış bulunamamıştır. Sonuç olarak uzun dönemde listerinin plak oluşumunu azalttığı ve oral patojenlere karşı etkili olduğu görülmüştür.
Yapılan başka bir çift-kör çalışmada listerin oral hijyene ek olarak kullandırılmış ve hidro-alkolle kıyaslandığında plak ve gingivitisi % 34 oranında önlediği bildirilmiştir. Overholser ve ark. 6 aylık bir çalışmada listerin, bir klorheksidin solüsyonu olan Peridex’in ve kontrol olarak hidro-alkolün, gingivitis ve plak gelişimi üzerine olan etkilerini incelemişler, bu dönemin sonunda oluşan bakteri plağının ve boyama ile yapılan ölçümlerinde, deneyin başlangıcında ve sonunda skor ölçümleri yapmışlardır. Çalışmanın sonunda Listerinin hidro-alkol kontrol grubuna oranla plak ve gingivitis gelişimini % 36 oranında önlediği kaydedilmiştir.
Bir başka ilginç sonuç ise Meiller ve ark.’nın rekürrent aftöz ülserasyonlar üzerine listerinin etkisini incelemek için yaptıkları çalışmada ortaya çıkmıştır. Araştırmanın sonucuna göre listerinin ortalama iki gün boyunca kullanılması, % 5’lik hidro-alkol içeren ağız gargaralarına oranla ülserasyonların şiddetinde azalmaya neden olmuştur. Ancak her iki gargarayı kullanan hastalarda ülserasyonların sayısında ve şiddetinde azalma olduğu bildirilmiştir.
Ağız gargaralarının klinikte kullanımı
Amerikan Dişhekimliği Birliği (ADA) tarafından onaylanmış ağız gargaralarının listesi Tablo 2’de görülmektedir. Klorheksidin ve triklosan, Amerikan Yiyecek ve İlaç Birliği (FDA) tarafından onaylanmış ürünlerdir. Triklosan içeren diş macunları Amerika’da FDA tarafından onaylanmıştır ancak triklosan içeren ağız gargaraları dünyanın çeşitli ülkelerinde satılmasına rağmen Kuzey Amerika’da satılmamakta ve FDA onayı bulunmamaktadır.
Aktif maddeleri ve formülasyonları aynı olan farklı ürünlerin klinik etkileri her zaman benzer olmayabilir. Ağız gargaraları genellikle topikal etkili sistemlerdir, ürünün formülasyonu, inaktif ve/veya aktif ajanın biouygunluğu ve biofilm penetrasyonu gibi özellikleri, klinik aktiviteyi etkiler. Bundan dolayı yeni veya farklı formülasyona sahip ağız gargaralarının klinik olarak test edilmiş aynı düzeyde aktif maddeye sahip diğer ürünlerle klinik etkinlik açısından karşılaştırılması için uygun çalışmalar planlanmalıdır.
Altı aylık çalışma sonuçları supragingival plak ve gingival indekslerle belirlense de, ağız gargaraları içerisindeki aktif antimikrobiyal ajanlar çalkalama sırasında tüm ağza yayılır. Bu yüzden dental plak bakterileri için rezervuar görevi gören tüm intraoral alanlarda (örn: dil sırtı) bakteri seviyelerini düşürüler. Yapılan pek çok çalışma da antiseptik ağız gargarası kullanımının dil bakteri seviyesinde ciddi düşüşe neden olduğunu göstermiştir.
Tablo 2: Ağız gargaralarının 6 aylık kullanımına bağlı plak/gingivitis etkileri
Aktif İçerik
Ticari ĂśrĂĽn
Plak Ă–nleme (%)*
Gingivitis Ă–nleme (%)
% 0.12 Klorheksidin
Peridex (Zila Farmasötik/Phoenix
50.3 – 60.9
30.5 – 42.5
Temel Yağların
Listerin Antiseptik (Pfizer, Morris Plains)
13.8 – 56.1
22.1 – 35.9
Kombinasyonları***
Cool Mint Listerin (Pfizer)**
Fresh Burst Listerin (Pfizer)**
Tartar KontrollĂĽ Listerin (Pfizer)**
% 0.05 Setilpridinum Klorid
Viadent (Colgate-Palmolive, New York)
29.02
24.0
% 0.03 Triklosan
Plax (Colgate Palmolive, )****
24.0 – 29.1
16.9 – 23.0
Actibrush (Colgate-Palmolive)
* : 6 ay sonunda negatif kontrol grubu ile kıyaslandığında
** : ADA tarafından onaylanmıştır.
*** : % 0.064 Timol, % 0.092 Okaliptol, % 0.060 Metil Salis ilat ve % 0.042 Mentol
**** : Triklosan içeren Plax, Kuzey Amerika haricindeki diğer ülkelerde satılmaktadır.
Tablo 2: Ağız Gargaralarının 6 Aylık Kullanımına Bağlı Plak/Gingivitis Etkileri
Aktif İçerik
Ticari ĂśrĂĽn
Plak Ă–nleme (%)*
Gingivitis Ă–. (%)*
% 0.12 Klorheksidin
Peridex (Zila Farmasötik/Phoenix)
50.3 - 60.9
30.5 - 42.5
Temel Yağların
Listerin Antiseptik (Pfizer, Morris Plains, N.J.)
13.8 - 56.1
22.1 - 35.9
Kombinasyonları ***
Cool Mint Listerin (Pfizer)**
FreshBurst Listerin (Pfizer)**
Tartar KontrollĂĽ Listerin (Pfizer)**
% 0.05 Setilpridinum Klorid
Viadent (Colgate-Palmolive, New York)
29.02
24.0
% 0.03 Triklosan
Plax (Colgate-Palmolive)****
24.0 - 29.1
16.9 - 23.0
Actibrush (Colgate-Palmolive)
* : 6 ay sonunda negatif kontrol grubu ile kıyaslandığında
** : ADA tarafından onaylanmıştır
*** : % 0.064 Timol, % 0.092 Okaliptol, % 0.060 Metil Salisilat ve % 0.042 Mentol
**** : Triklosan içeren Plax, Kuzey Amerika haricindeki diğer ülkelerde satılmaktadır.
Klorheksidin:
Yaklaşık 50 yıldır bilinen ve üzerinde en çok çalışılan antimikrobiyal bir ajandır. Gram pozitif ve gram negatif bakterilere, mayalara ve virüslere etkilidir. Mutans streptokokları ve Porphyromonas Gingivalis’in yüksek koloni sayılarını indirmek için, kök yüzey çürük riski artmış yaşlılarda, herpetik ağız lezyonları, kandida enfeksiyonlu protez hastaları, baş-boyun kanserleri ile ilgili radyoterapi ve kemoterapi gören hastalarda sekonder enfeksiyon riskini önlemek için kullanılır. HIV ve Hepatit B virüsüne de etkilidir. Klorheksidinin antibakteriyel etkisi, bakteriler tarafından absorbsiyonuyla ilişkilidir. Nötral pH’da pozitif yüklü klorheksidin molekülü, negatif yüklü bakteri hücre duvarına adsorbe olur. Asit koşullarda adsorbsiyon azalır.
Klorheksidin geniş bir antimikrobiyal spektrumu olan bir katyonik bi-biguanid’dir. Ağız gargaraları içinde klorheksidini üstün kılan özelliği dayanıklılığıdır. Bu özelliği nedeniyle ikinci jenerasyon ajandır. Ağız boşluğundaki yüzeylere kuvvetlice bağlanır ve yavaş salınımla etkisini sürdürür. Klorheksidinin % 0.1, % 0.12 ve % 0.2’ lik solüsyonları bulunmaktadır. Yurt dışında reçete ile satılan klorheksidin farklı ticari preparatları Peridex, PerioGard, Corsodyl, Chlorhexamed Fluid, Clorhexidine Dental Solution, Hibitane, Orahexal gibi isimler altında satılmaktadır.
Peridex, pH 5.5’lik % 11.6 alkolde % 0.12 klorheksidin diglukonattır ve ADA tarafından onaylanmış ağız gargarasıdır. Önerilen kullanım şekli diş fırçalamaya ek olarak günde iki kez 10-15 ml. miktarlarda 30-45 saniye ağzın çalkalanmasıdır. 2-4 hafta kullanılabilir. Dikkat edilmesi gereken en önemli nokta diş fırçalaması ile klorheksidinli gargara arasında en az 30 dakika aralık bırakılmasıdır. Çünkü diş macunlarında bulunan sodyum lauril sülfat ya da anyonik florürler katyonik olan klorheksidini inaktive ederler.
Klorheksidin ağız içinde, dil ve diş üzerinde renk değişikliklerine neden olabilir. Dil üzerindeki renk değişikliği, yüzeysel hücreler üzerindeki glikoproteinlerin renklenmesine bağlıdır. Klorheksidin kullanımı kesildikten sonra boyanmış hücre katmanlarında deskuamasyon gerçekleşeceğinden renk değişikliği kendiliğinden ortadan kalkar. Dişler üzerindeki renk değişikliği dişe tutunan salya kökenli glikoproteinlerin ve diğer eklentilerin boyanması ile meydana gelir. Söz konusu yakınmalar, aşırı plak birikimi olan bireylerde daha fazladır. Ayrıca yüzeyi pürüzleşmiş diş dolguları ve pürüzlü diş yüzeyleri glikoproteinlerin tutunmasına elverişli oldukları için daha fazla boyanırlar ve böylece renk değişikliği daha fazla gözlemlenir. Diş yüzeyindeki renk değişiklikleri hastaların diş macunları ile ağız temizliği yapabilecekleri duruma gelmeleri ile büyük çapta ortadan kaldırılır. Pürüzlü diş yüzeyleri ve pürüzlü dolgularda kalan renk değişiklikleri diş hekimi tarafından kolaylıkla giderilebilir.
Benzidamin hidroklorĂĽr:
Benzidamin nonsteroid antienflamatuar ajanlar (NSAİİ) grubunda, farklı farmakolojik profil ve farmakokinetik özelliklere sahip bir moleküldür. Lipofilik karakterde olup, bütün membranları stabilize edici ve lokal anestezik etkiye sahiptir. Prostaglandin sentezini, mukopolisakkaridlerin koruyucu görevini, vücudun normal reaksiyonlarını ve iyileşme olayını engellemez; ülserojen etkisi yoktur. Böylece benzidamin; cerrahi, travmatik v.s. sebeplerle yumuşak doku zedelenmesi sonucu meydana gelen akut (primer) enflamasyonun lokal mekanizmalarını etkileyerek antienflamatuar, antiödem, antitrombotik etkisine bağlı analjezik etki gösterir.
Topikal uygulama sonucu iyi absorbe edilmesi ve oral dozdan daha düşük dozla, oral dozla ulaşılan doku konsantrasyonunun sağlanması, buna karşılık plazma konsantrasyonunun oral dozla sağlanandan çok az olması gibi farmakokinetik özellikleri vardır.
Listerin:
Bugün hala kullanılmakta olan ve en eski ajanlardan olan listerin yağ esaslı bir fenol bileşiğidir. Listerin, % 26.9 hidroalkolik taşıyıcıda mentol ve metilsalisilat ile birlikte fenolle ilişkili esansiyel yağların bir kombinasyonudur. ADA tarafından ilk onaylanan antiplak ve antigingivitis gargaradır. Bu formül karbolik asitten türemiş ve 100 yılı aşkın süredir kullanılmaktadır. Fakat dental hastalıklarda ağız gargarası olarak kullanımı ancak son yıllarda güvenli bir şekilde olmuştur. Ağız boşluğunda kandidiazis kontrolü için de önerilmektedir. Listerin ile küretaj öncesi subgingival yıkama yapıldığında bakteriyemi ile ilişkili aerob ve anaerob bakterileri büyük ölçüde azalttığı saptanmıştır. Listerin uzun yıllar antiplak ajanı olarak kullanılmasına rağmen, klorheksidin içeren gargaraların gelişi hastalıkları önleme açısından daha çok önemli bir buluş olarak göze çarpmaktadır.
Triklosan:
Triklosan, iki fenol ve bir noniyonik germisiddir. Toksisitesi düşüktür. Antibakteriyel aktivitesi geniş spektrumludur. Triklosan, çinko sitrat ve gantrez olarak adlandırılan bir kopolimer olan polivinil metil eter ve maleik asit ile kombine edilmiş olarak diş macunu ya da gargara formunda bulunmaktadır. Çinko sitrat ile kombinasyonun antiplak ve antikalkulus özelliklerini artırdığı, gantrez ile kombinasyonun retansiyon zamanını artırdığı ileri sürülmektedir. Çalışmalar ağız florasında değişikliğe yol açmadığını ve bakterilerde direnç gelişmediğini göstermektedir. % 3 triklosan ve % 0.25 gantrez ağız gargarası fırçalama öncesi ya da sonrası kullanımla plakta anlamlı derecede azalma sağlamaktadır.
Sanguinarin:
Sanguinarin Amerika ve Kanada’da yetişen Sanguinaria canadensis adlı kan otu bitkisinden elde edilen bir alkaloiddir. Formülü % 0.01 saf sanguinarine eş, % 0.03 karışık ekstre ve % 0.2 çinko klorür içerir. Çinko eklenmesi antiplak özelliğini artırmıştır. Amerika’ da Viadent ve İngiltere’ de PerioGard adlarıyla satılmaktadır. Her iki ürün de ADA tarafından onaylı değildir. Bazı hastalarda yanma yakınması dışında boyama, diş taşı oluşumu ya da tat duyusunda bozukluk gibi yan etkileri yoktur. Gargara formu pH 4.5’de % 11.5 alkol içerir. Macun pH’sı 5.2’ dir.
Wennström ve Lindhe, sanguinarin ile plak oluşumu ve gingivitis üzerine % 0.03’lük sanguinarin ekstresi içeren bir ağız gargarası ile 2 haftalık bir çalışma yapmışlardır. Kontrol grubu olarak aynı renk ve tatta başka bir plasebo kullanmışlardır. Sanguinarin kullanan hastalardaki plak indeksi kontrol grubuna oranla % 40 ve gingivitis skoru kontrol grubuna oranla % 25 daha az ölçülmüştür. Hastalar bu periyod boyunca dişlerini fırçalamamışlardır. Dilin dorsumu ile dişlerde çok hafif renkleşme dışında herhangi bir sorunla karşılaşmamışlardır.
Moran ve ark. gingivitis oluşumu üzerine yaptıkları bir başka çalışmada Sanguinarin-çinko ağız gargarası ile % 0.2 klorheksidin ağız gargarasının etkinliklerinin değerlendirmişlerdir. Pozitif kontrol grubu olan klorheksidin, sanguinarine oranla gingivitis ve plak ölçümlerinde oldukça etkili bulunmuştur.
Sodyum benzoat ve sodyum lauryl sĂĽlfat:
Plax fırçalama öncesi kullanılan sodyum benzoat ve sodyum lauryl sülfat içeren bir ağız gargarasıdır. Yalnızca fırçalamaya oranla plak miktarında % 300 oranında azalma sağlar. Emling ve Yankell, 1991 ‘de yaptıkları bir çalışmada 20 hastaya fırçalama öncesi Plax ile gargara yaptırılmıştır. Bukkal ve lingual yüzeylerdeki plak miktarında, su ile çalkalama yapmış plasebo grubuna oranla plak miktarında anlamlı bir azalma ölçmüşlerdir. 1989’ da yapılmış başka bir çalışmada Plax ile Listerin karşılaştırılmıştır. Kontrol grubu plasebo olarak içeriğinde herhangi bir madde olmayan renkli ve kokulu su kullanılmıştır. Plax, listerin ve/veya plaseboya oranla plak miktarını azaltma konusunda daha iyi sonuçlar göstermiştir. Ayrıca plak skorları da 3 aylık çalışmada normal ölçülmüştür.
Sodyum lauryl sĂĽlfat (sls):
SLS, protein moleküllerine yüksek derecede afinitesi olan hidrofobik organik bölüme sahip bir anyonik ajandır. Ağız gargarası ve macun formları vardır.
Barkwell ve Rolla 1989’ da allerjik stomatitisleri olan hastaların oral mukozalarında, SLS’ in etkilerini incelemişlerdir. Sonuçta SLS’ in denatürasyon etkisinin ağızda bulunan yiyeceklerdeki protein miktarı ile doğru orantılı olarak arttığını bulmuşlardır. Çalışmalar % 1’ lik SLS’ in ağız gargarası formunun , % 0.02 triklosan içeren ağız gargarası ile aynı etkiye sahip olduğunu göstermektedir.
Heksetidin:
Oraldene aktif içeriği Heksetidin olan bir üründür. % 0.1 heksetidin içeren Oraldene ile yapılan bir çalışmada 7 gün boyunca günde 3 kez oral hijyeni düzeltmek için ağız gargarası olarak kullandırılmıştır. Plak miktarında ciddi bir azalma ölçülmüştür. Plasebo grubuna oranla total plak indeksi Oraldene kullanan grupta % 40 oranında daha az bulunmuştur. Oraldene geriye dönebilen birkaç yan etkiye sahiptir. Tat almada değişiklik ve bozulma, hafif ülserasyon, hassasiyet ve hissizlik görülebilir.
Delmonipol:
Delmonipol diş yüzeyine tutunan bakteri retansiyonunu ve bunu takiben oluşan dental plaktaki antimikrobiyal atakları önlemede alternatif bir yaklaşımdır. Delmonipol ile ilgili çok az çalışma yapılmıştır fakat son zamanlarda Collaert ve ark. delmonipol hidrokloridi diş yüzeyinde aktif bir ajan olarak kullanmışlardır. İçeriğindeki amino alkolünün tükrük mikroflorası üzerine küçük etkileri vardır. Gingival kanama indeksleri karşılaştırıldığında klorheksidin ve % 0.02 delmonipol gargaraları arasında anlamlı bir fark bulunmamıştır. Klorheksidin ve delmonipol 2 hafta boyunca oral hijyeni düzeltmek için kullandırılmış, 2 hafta sonunda tükrük örnekleri alınmış, diş eti oluğu sıvıları ölçülmüş, ginivitis gingival indekslerle skorlanmış, plak ölçülmüş ve plak indeksleri işaretlenmiştir. Klorheksidin ile anaerob, aerob ve S. Mutans sayısında azalma ölçülmesine rağmen, Delmonipol ile bu sayılarda herhangi bir anlamlı değişiklik bulunmamıştır.
Çinko tuzları:
Ağır metal tuzlar, antibakteriyel özellikleri nedeniyle kullanılmaktadır. Çinko tuzlarının bir diğer özelliği ise plaktaki asit oranını azaltmasıdır. Çinko tuzlarının macun formları ağız gargarası formundan daha çok kullanılmaktadır.
Giertsen ve ark. çinko kloridin plak birikimi üzerine ve asit üretimine olan etkilerini doza bağımlı olarak incelemişlerdir. Hastalara 4 gün boyunca günde iki kez 5, 10, 20 ve 100 mmol/L ZnCl2 ile çalkalama yapmaları söylenmiştir. Hastalar bu süre boyunca diğer ağız hijyenlerinden yoksun bırakılmışlardır. Aynı zamanda bu çalışmada sükroz içeren sakız çiğnetilmiş ve plak indeksleri de 0, 1, 2 ve 3 olarak değerlendirilmeye alınmıştır. 6 kişilik bir başka grup plasebo olarak seçilmiş ve bu gruba 5 mmol/L veya 100 mmol/L 3 gün boyunca kullandırılmıştır. Plak ölçümlerinde 5, 10 ve 20 mmol/L ZnCl2 kullanan hastalarda anlamlı bir azalma bulunmasına rağmen 100 mmol/L kullanan hastalarda plak miktarı daha fazla ölçülmüştür. İkinci grupta ağır plağa sahip 6 öğrencide 100 mmol/L konsantrasyonu plak akümülasyonunda azalma sağlamıştır.
Ayrıca çinko iyonlarının dişlerdeki bakteri absorbsiyonunu ve plak artışını engellediği bulunmuştur.
Antifungal ağız gargaraları:
Topikal uygulamalarda kullanılan ajanların en büyük avantajı yan etkilerinin ve sistemik toksik özelliklerinin sistemik kullanıma oranla yok denecek kadar az olmasıdır. Antifungal özellikteki ağız gargaralardan süspansiyon formunda ülkemizde yalnızca nistatin içeren preparatlar mevcuttur. Oral kandidiazisin en büyük etkeni olan Candida Albikansın mikrobiyolojik olarak tespitinden sonra hekim tavsiyesi ile kullanılması gereklidir. Genel olarak mantarlar fırsatçı organizmalar olduklarından dişhekimliği ve tıpta antifungallerin sistemik ve topikal uygulamaları özellikle RT ve/veya KT tedavisi gören hastalar, AIDS hastaları ve herhangi bir nedenle immun sistemi baskılanmış tüm hastaları kapsayacak kadar geniştir. Bu başlık altında kısaca özetlenen antifungal ağız gargaraları bu nedenle başlı başına bir yazı konusu olabilirler.
Sonuç:
Kullanımı tarih öncesine dayanan ağız gargaraları, bugünde gerek doktor ve dişhekimlerinin tavsiyesi ile gerekse bireylerin (özellikle halitozis şikayeti bulunanlar) gereksinimlerine göre marketlerden temin edilebildikleri ürünlerdir. Eldeki veriler, ağız gargarası kullanımının, yeterli plak ve gingivitis kontrolünü mekanik metotlarla sağlayamayan bireylerde destekleyici olarak uygulanmasını öngörmektedir. Diş hekimleri, hastalarına antiplak özellikli bu tür ürünleri tavsiye ederken hastaya ağız gargarası kullanımının mekanik oral hijyen prosedürlerine bir alternatif olmadığını ancak birlikte uygulandığında başarılı sonuçlar verdiğini anlatılmalıdır. Bu grubun dışında yer alan ağız gargaraları sadece hekimlerin tavsiyesi ile belirtilen süreler boyunca kullanılmalı ve birer ilaç oldukları unutulmamalıdır.
Kaynaklar:
1.Külekçi G, Çintan S, Dülger O. Diş Hekimliğinde Antimikrobiyal Ağız Gargaralarının Kullanımı. ANKEM Derg 1999;13(3):208-213.
2.Adams D, Addy M. Mouthrinses. Adv Dent Res 1994;8(2):291-301.
3.Netuschil L, Hoffmann T, Brecx M. How to select the right mouthrinses in periodontal prevention and therapy. Part 1. Test systems and clinical investigations. Int J Dent Hygiene 2003;1:143-150.
4.Barnett ML. The rationale for daily use of an antimicrobial mouthrinse. JADA 2006;137(suppl):16S-21S.
5. Barnett ML. The role of therapeutic antimicrobial mouthrinses in clinical practice. JADA 2003;134:699-704.
DiĹźhekimliÄźinde Enfeksiyon KontrolĂĽ
Dt. Senem Özer, Dt. Sırmahan Çakarer, Doç. Dr. Mehmet Yaltırık,
Prof. Dr. Cengizhan Keskin
Günümüz sanayi toplumunda yaşayan insan için kişisel ve genel hijyene ait modern uygulamaların etki alanına girmemek zor olur. Modern ve uygar toplumların kültürüne kişisel temizlik ve genel sağlığı koruma, ailevi ve kamusal eğitim yoluyla girmiş, hükümet düzenlemeleri ve medya reklamları ile de yerleşmiş ve güçlenmiştir. Hijyen konusundaki bu bilinç, enfeksiyon hastalıklarının kontrolü için gerekli olan hijyen önlemlerinin öneminin çok da farkında olunmadığı önceki yüzyıllarla açık bir şekilde çelişiyordu. Semmelweis, Koch ve Lister’in çalışmaları asepsi konusunun aydınlatılmasını sağlamıştır.
Bu yüzden bugün aseptik tekniğin kullanımı tamamen rutin olarak gerçekleşmektedir.
Enfeksiyon kontrol alanındaki devam eden gelişmelere bağlı olarak sağlık alanında çalışanlar bulaşıcı hastalıkların yayılımını önleyen teknikleri öğrenmeli ve uygulamalıdır. Bu durum işlem sırasında enfeksiyona karşı koruyucu bir bariyer olan epitelyal yüzeyin bütünlüğü bozulduğu ve hekim, yardımcı ve aletlerin hastanın kanı ve tükürüğü ile kontamine olduğu için özellikle diş hekimleri için önemlidir.
Enfeksiyonun önlenmesi konusunun tam olarak anlaşılması ve açıklığa kavuşturulması için kimi zaman karışıklığa yol açabilen terminolojinin iyi bilinmesi gerekmektedir.
Temizleme: Bir eşyadan yabancı maddeleri (toprak, organik maddeler, mikroorganizmalar v.b.) uzaklaştıran işlemdir.
Asepsi: Sepsisin önlenmesi amacı ile işlemin yapılacağı sahada bulunan tüm materyallerin tüm mikroorganizmalardan arındırılması işlemidir.
Antisepsi: Canlı dokuda mevcut mikroorganizmaların temizlenmesi işlemidir.
Antiseptik: Deri ve mukoza gibi canlı dokulara uygulanan kimyasal ajandır. Bu ajanın görevi mevcut mikroorganizmaların aktivitelerini durdurarak ya da ortadan kaldırarak sayılarını azaltmaktır.
Dezenfeksiyon: Cansız materyal üzerindeki patojen organizmaları öldürme işlemidir. Bu işlem için kullanılan ajanlara dezenfektan adı verilir. Dezenfeksiyon ile spor ve virüsler ölmeyebilir.
Sterilizasyon: Tüm mikroorganizmaların öldürülmesi işlemidir ve kesin bir durumu ifade eder yani derecesi, azlığı ya da çokluğu söz konusu değildir. Sterilizasyon ya vardır ya da yoktur.
Sanitizasyon: Yaşayan mikroorganizmaların sayısını ve çoğalmasını azaltarak bunların toplum sağlığını tehlikeye sokmayacak düzeyde tutulmasıdır.
Bugün enfeksiyon kontrolünde evrensel standart önlemler kullanılmaktadır.
Evrensel Standart Ă–nlemler:
Her işlem öncesi ve sonrası ellerin sabun ve suyla yıkanması.
Kan ve vücut sıvıları ile temasta eldiven, maske, önlük, gözlük gibi koruyucu bariyerlerin kullanımı.
Kontamine aletlerin dezenfeksiyonu
Kirlenen önlüklerin sıcak su ve deterjan ile bekletilmeden temizlenmesi.
Tüm enjeksiyonlar için tek kullanımlık enjektör kullanılması.
Keskin ve kontamine aletlerin delinmeye dirençli kutularda toplanarak ortamdan uzaklaştırılması.
Perkütanöz işlemlerde kullanılan tüm tıbbi ekipmanın sterilizasyonu.
Koruyucu Giysiler ve Bariyer Uygulamaları:
Kan ve kan ürünleri, kan ile kontamine tükrük veya müköz membran ile temas etme durumunda diş hekimleri ve personeli mutlaka eldiven kullanmalıdırlar. Nonsteril eldivenler; cerrahi olmayan işlemler ve muayene için; steril eldivenler ise cerrahi işlemler için kullanılmalıdır. Her hasta tedavisi öncesinde diş hekimi ve personeli ellerini yıkayarak yeni eldiven giymeli, tedavi sonrası eldivenlerini çıkarıp yeniden ellerini yıkamalı, cerrahi eldivenler veya muayene eldivenleri kullanım sonrası yıkanarak tekrar kullanılmamalı veya yeniden kullanılmak üzere dezenfekte veya sterilize edilmemelidir. Tek kullanımlık eldivenler dışında koruyucu gözlük, maske ve önlük kullanımı, yüzeylerin alüminyum folyo, plastik ya da kağıt örtülerle kapatılması da işlem sırasında hekimin, yardımcı personelin ve işlemin yapıldığı sahanın kontaminasyonunu önlemede son derece önemli ve vazgeçilmesi mümkün olmayan önlemlerdir. Ağız ve burunu kapatan standart cerrahi maske, dental işlem sırasında müköz membranların sıçrayan damlacıklardan korunulması için giyilmeli, her hasta arasında ve işlem sırasında ıslanması durumunda hemen değiştirilmelidir. Yeniden kullanılabilen yüz koruyucuları su ve sabun ile temizlenebilir ya da dezenfekte edilebilir. (Resim 1a, 1b)
Resim 1a, 1b: Koruyucu giysiler
El Hijyeni:
Su ve sabun ile el yıkama mikroorganizmaların arındırılmasında, cerrahi olmayan işlemler ve hasta muayenesi için yeterlidir. Tedavi sırasında delinen veya yırtılan eldivenler beklenmeden çıkarılmalı, hekim veya personel ellerini yıkayıp eldiven değiştirdikten sonra tedaviye devam etmelidirler. Sabun; bakteri sayısını azaltmada yeterli olmakla birlikte antimikrobiyal sabunlar ve alkol bazlı maddeler mikroorganizmaların hayatta kalmasını engellemede daha etkin bulunmuştur. Alkol kullanımı öncesi el, su ve sabun ile yıkanmalıdır. Cerrahi işlemler öncesinde antimikrobiyal sabun ve cerrahi el fırçası ile, ön kol da dahil olmak üzere eller yıkanmalı, steril eldiven giyilmeli ve steril yıkama solüsyonu kullanılmalıdır.
Keskin Alet ve İğnelerin Kullanımı:
Bistüri ucu, enjektör iğnesi ve tel gibi kan veya tükürük ile kontamine keskin aletler potansiyel enfeksiyon taşıyıcısı olarak görülmeli, yaralanmayı önleme düşüncesi ile hareket edilmelidir. Kullanılmış enjektörler kesinlikle tekrar kullanılmamalı, kullanım sonrası ortamdan kolaylıkla uzaklaştırılabilecek şekilde delinmeye dirençli kutularda toplanmalı; kutuların ¾’ü dolduğunda ortamdan uzaklaştırılmalıdırlar. (Resim 2)
Resim 2: Tıbbi atık kutusu
Dental Ünit ve Çevre Yüzeylerin Temizlenmesi ve Dezenfeksiyonu:
Her hasta sonrası değiştirilmek üzere kaplanabilir. Özellikle temizlenmesi zor bölgeler için önerilen bu uygulama zararlı kimyasal dezenfeksiyonlara maruz kalınmasını azaltması bakımından önemlidir. (Resim 3a, 3b)
Resim 3a, 3b: Yüzeylerin kaplanması
Tek Kullanımlık Aletler:
Profilaksi fırça ve kapları, tükürük emiciler, enjektörler, aspiratör uçları her kullanım sonrası atılmalıdırlar.Bu aletler sterilizasyon veya dezenfeksiyona uygun olarak tasarlanmamıştır.
Aletlerin Sterilizasyonu:
Alet sterilizasyonundaki temel mantık temizlenip paketlenmiş aletlerin üzerinde kalan mikroorganizmaları öldürerek, hastanın tedavi süresince güvenliğini temin etmeye yardımcı olmaktır. Ağız aletlerini steril etmenin hala kabul edilen iki yöntem; ısı ile sterilizasyon ve kimyasal gaz sterilizasyonudur. Alet sterilizasyonunun ilk aşaması aletlerin temizlenmesidir.
Aletlerin temizlenmesi:
Protein ve diğer polimoleküler yapılar özellikle kuru oldukları zaman mikroorganizmalar için koruyucu bir yapı oluştururlar ve sterilizasyonun yapılmasını engellerler. Bu nedenle kullanıldıktan sonra aletler kuru bir şekilde bırakılmamalı, su altında fırçalanarak kan, tükürük ve nekrotik materyalden arındırılmalıdır. Bu amaçla ultrasonik temizleme cihazları kullanılabilir.
Aletlerin üzerindeki kalıntıları uzaklaştırırken sabun ve deterjanlardan yararlanılır. Aseton, eter ve ksilen gibi maddeler de bazen temizlikte kullanılırlar fakat canlı dokuda yakıcı etki yapmaları, pahalı ve sabun ile deterjana göre daha az etkili olmaları nedeni ile fazla tercih edilmezler.
Isı ile sterilizasyon: Yüksek ısı mikroorganizmaların ortadan kaldırılmasından kullanılan en eski yöntemdir. Isı ile sterilizasyonda kuru sıcak hava ve nemli sıcak hava olmak üzere iki yöntem kullanılmaktadır. Kuru sıcak hava sterilizasyonunda mikrobiyal yaşamın en dirençli formu olan sporların da ortadan kaldırılabilmesi için daha yüksek ısılarda daha uzun zamana ihtiyaç vardır. Bu işlem nemli sıcak hava sterilizatörlerinde daha kısa sürede ve düşük ısılarda başarılabilmektedir.
Kuru sıcak hava sterilizasyonu: Günümüzde halen en sık kullanılan yöntemdir. Sıcak havadan yararlanabilmek için aletin ısısının istenilen dereceye ulaşması, materyalin ısı iletme yeteneğinin olması ve aletin içinde hava sirkülasyonunun olması gerekir. Kuru havanın etki mekanizması dehidratasyon ve oksidasyondur. Yağ ve pudraya etki etmediğinden ve bunları içeren malzemeler başka yöntemlerle steril edilmelidir. Kuru sıcak hava sterilizasyonu için 121°C de 6–12 saat, 140°C de 3 saat, 160°C de 2 saat veya 170°C de 1 saatte gerçekleştirilir. Bu yöntem ucuz ve güvenilir bir yöntemdir, aletlerde paslanma yapmaz, ancak sterilizasyon süresi biraz uzundur.
Nemli sıcak hava sterilizasyonu: Basınç altındaki nemli buhar sterilizasyon yöntemleri içinde en etkili ve pratik olanıdır. Daha düşük sıcaklıklarda etkili olabildiği ve daha kısa sürede sterilizasyon gerçekleştirdiği için kuru sıcak hava ile sterilizasyondan daha verimli bir yöntemdir. Ancak aletlerde paslanma ve körelme meydana getirebilmektedir. Nemli sıcak hava sterilizasyonu otoklav denilen aletlerle yapılır. 15 psi basınçta 121.5°C de 10–12 dk da tüm canlılar ölürler. Ancak daha yüksek ısı ve basınç ile sterilizasyon süresini kısaltmak mümkündür. Normal bir sterilizasyon 20–30 dk bekletilerek elde edilir. Malzemeler kumaş bohçalara sarılarak yada özel otoklav poşetlerinde steril edilirler. Özel otoklav poşetlerinde steril edilen aletler 6 ay ile 1 sene arasında steril olarak muhafaza edilebilmektedir. (Resim 4)
Resim 4: Otokav poĹźetleri
Paketler otoklav sterilizasyonundan ıslak çıkar. Elle tutulduğunda kağıt ya da plastik olan bu paket kolayca yırtılabilir ve bu sterilizasyonun ve paketlemenin tekrarını gerekli kılar. Islak paketin üzerindeki su ayrıca paket dışındaki bakterilerin içeri girişine sebep olur. Bu yüzden paketler kurutulmadan otoklavdan çıkartılmamalıdır.
Enstürümanların sterilitesi, depolama ve dağıtım aşamasında da korunmalıdır. Daha önce belirtildiği üzere, paketlenmemiş enstürümanların raf ömrü yoktur. Buna ek olarak, paketleme materyalinin devamlılığının bozulması paket içeriğinin sterilitesini tehlikeye sokar. Bu paketlerin nemlenmesinden ya da stres altında yırtılması nedeni ile oluşabilir. Bu sebepten, ıslak paketler tutulmamalı; paketlerin tutma kısımları ile temas minimuma indirilmeli; paketler kuru ortamda fakat ısı kaynaklarından uzak bulundurulmalı; depolanma sırasında fazla baskıya maruz kalmamalı ve az tozlu bir ortamda saklanmalıdırlar. Hasta tedavisi sırasında bilhassa kontamine eldivenlerle çekmecelerin tutulmaması kuralına uyulamayacağı durumlarda, paketlerin çekmecelerin ön bölmelerinde tutulması risklidir. Raf ömrü değişkendir. Bu, paketler açılmadan ne kadar steril kalacaklarına dair spesifik bir kural olmadığı anlamına gelir. Ya da raf ömrü paket materyalinin içeriğinin devamlılığına bağlıdır. Bu da paketin diğer hasta önüne çıkarılana kadar hiçbir zaman ıslanmaması ve yırtılmamasıyla direkt olarak ilişkilidir.
Kimyasal gaz sterilizasyonu: Bazı gazlar bakterilerin enzimleri ve diğer vital biyokimyasal yapıları üzerinde hasar oluşturarak bakterilerin öldürülmesi için kullanılırlar. Bunlar içinde en sık kullanılanı etilen oksit gazıdır. Kimyasal gaz ile sterilizasyon ısıdan bozulan malzemelerin sterilizasyonu için ideal bir yöntemdir. Etilen oksit gazı normalde son derece yanıcıdır, bu nedenle karbondioksitle karıştırılarak bu tehlike ortadan kaldırılır. 50°C de 3 saatte sporlar da dahil tüm mikroorganizmaları öldürür. Poröz yapılı, ısı ve neme hassas olan materyallerin sterilizasyonunda kullanılabilir olması en önemli avantajlarıdır. Ancak sterilizasyon süresi ve dokuda toksitite meydana getirmemesi için gerekli olan havalandırma süresi uzundur.
Sterilizasyonun etkinliğinin gözlenmesi hasta güvenliğinin sağlanması açısından önemlidir. Biyolojik gözlemleme (spor testi) sterilizatörün, yaygın hastalıkları oluşturan mikroorganizmaların yanı sıra hayli dayanıklı bakteri sporlarını da öldürüp öldürmediğinin anlaşılmasını sağlar. ADA ve CDC bu tip gözlemlemenin haftada bir yapılması gerektiğini bildirmişlerdir. Bacillus stearothermophilus buharlı ve doymamış kimyasal buharlı sterilizatörlerinde kullanılırken, bacillus subtilus sıcak hava sterilizatörlerinde kullanılır. Spor testlerinde kullanılan test materyalleri birçok diş hekimliği fakültelerinden elde edilebilir.
Spor testi yapılırken dikkat edilecek husus test kağıdının sterilize edilecek poşetin tam ortasına, poşetin ise sterilizatörün içinde üretici firmanın belirttiği herhangi bir yere yerleştirilmesi gerekmektedir. Herhangi bir problem durumunda sterilizatör kullanımdan çıkartılıp hatanın nedeni bulunmalı, spor testleri negatif çıkıncaya kadar alet fonksiyona sokulmamalıdır. Hatalar bazen aletlerin yanlış poşetlenmesi ya da sterilizatörün içine yanlış yüklenmesi gibi kullanıcı hatalarından dolayı da kaynaklanabilir. Aynı zamanda sterilizatördeki bozukluk da hataya sebebiyet verebilir. Bu yüzden spor testleri fonksiyonların değerlendirilmesinde de kullanılabilirler.
Bir ikinci gözlemleme metodu da sıcaklıkla birlikte renk değiştiren özel mürekkeplerle yapılan kimyasal gözlemleme metodudur. Bu belirteçler otoklav bantları, yapışkanları, ya da poşetleri dışardan işaretlemekte kullanılan özel kalemler şeklinde bulunurlar. Bu belirteçlerin, sterilizatörün etkisinin paketlerin içine işleyip işlemediğinin kontrolü için paketlerin içine de yerleştirilmeleri gereklidir. Belirteçlerin dışarıda olması aletlerin sterilize edilip edilmediğin anlaşılmasında yardımcı olur.
Aletlerin dezenfeksiyonu: Dental enstrümanların bir kısmı ısıya dayanıksızdır, gaz sterilizasyonuna da uygun değildir ve tam bir sterilizasyon gerekli değildir. Bu durumda kimyasal dezenfektanlar kullanılabilir. Bu kimyasallar yüksek, orta ya da düşük biyosidal aktivitelerine göre sınıflandırılırlar. Sınıflandırma, ajanın vejetatif bakteri, tüberküloz basili, sporlu bakteri, nonlipid virüs ve lipid virüsleri öldürebilme etkinliğine göre yapılır. Düşük biyosidal aktiviteli ajanlar vejetatif bakteriler ve lipid virüsler üzerine etkili iken, orta grup dezenfektanlar bakteri sporları dışındaki tüm mikroplara karşı etkilidir. Yüksek biyosidal aktiviteli ajanlar ise tüm mikroorganizmaları öldürürler.
Dental enstrümanların dezenfeksiyonunda en sık kullanılan ajanlar gluteraldehit, iyodofor bileşikleri, klorin bileşikleri ve formaldehittir. Ancak en sık gluteraldehit tercih edilmektedir. Alkoller dental dezenfeksiyon için uygun değildir çünkü çok hızlı bir şekilde buharlaşırlar. Hepatit B virüsüne karşı etkili olmadığı ve sabun ve anyonik ajanlar ile inaktive edildiği için kuarterner amonyum bileşikleri de dental dezenfeksiyon için tavsiye edilmezler.
Maksimum dezenfeksiyonun sağlanabilmesi için uygun solüsyon, üretici firmanın önerdiği şekilde ve sürede uygulanmalıdır. Enstrüman, önerilen süre boyunca tamamen solüsyonla temasta olmalı ve bu süre içinde kontamine olmuş başka bir enstrüman solüsyon içine ilave edilmemelidir. Tüm enstrümanlar solüsyon içine bırakılmadan önce kan ve diğer tüm atıklardan temizlenmiş olmalıdır. Dezenfeksiyon sonrası enstrümanlar kimyasaldan arındırılacak şekilde durulanmalıdır.
Piyasemen ve angldruvalar ısıya fazla dayanıklı aletler olmadıkları için sıcak hava sterilizatörlerine koyulmazlar. Genellikle dış yüzey dezenfektanı ile silinerek temizlenirler. Ancak tükürük ve kan ile kontamine olan iç yüzeyler temizlenmeden kalırlar. Günümüzde gelişen teknoloji ile ısıya dayanıklı piyasemen ve angldruvalar üretilmiştir ve bu aletlerin idealde her hastada steril edilmesi gerekmektedir. Bu aletler için kuru sıcak havadan ziyade nemli sıcak hava sterilizasyonu önerilmektedir. Aletin ömrünün uzun olması açısından aletler sterilizatöre girmeden önce yağlanmalıdır. Yüksek devirde çalışan bu aletler her hastadan sonra 20-30 sn süre ile çalıştırılarak hastadan geri çekilen materyalin basınçlı su ile uzaklaştırılması sağlanmalıdır.
Frezlerin sterilizasyonu için ise kuru sıcak hava, kimyasal sterilizasyon ve etilen oksit sterilizasyonu önerilmektedir. Endodontik aletlerin sterilizasyonunda otoklav en güvenilir yöntemdir. Sapları çıkartılıp otoklava koyulamayacak sonik ve ultrasonik kazıyıcı aletlerin sapları işlem sırasında streç film ile kapatılmalıdır, bazı modeller için kimyasal dezenfeksiyon geçerlidir. Aynı işlem ışık veren aletler, ünitin steril edilmesi mümkün olmayan elle tutulan aksamları için de geçerlidir. Elektrocerrahi aletlerinin uçları, bazen sapları, kabloları otoklava girebilir.
Kaynaklar:
Miller CH. Instrument sterilization and beyond. Am J Dent 2002; 15: 137-138.
Molinari JA. Dental infection control at the year 2000. Accomplishment recognized. JADA 1999; 130: 1291-98.
Sailer HF, Pajarola GF. Color Atlas of Dental Medicine. Oral Surgery for the General Dentist. 1st ed.
New York, Thieme, 1999; 23-26.
Peterson LJ, Ellis E, Hupp JR, Tucker MR: Contemporary Oral and Maxillofacial Surgery. 4th ed.
St. Lois, Mosby Year Book, Inc, 2003; 63-74.
Türker M, Yücetaş Ş. Ağız, Diş, Çene Hastalıkları ve Cerrahisi. 2. baskı. Atlas Kitapçılık, Ankara,
1999; 153-162.
